
基于PD-1/PD-L1通路的疗法已经是当今肿瘤免疫治疗领域的绝对热门,但随着PD-1 /PD-L1抗体用于越来越多不同类型的肿瘤病人时,研究者们发现抗PD通路疗法并不是对所有肿瘤病人都有效,PD-1/PD-L1抗体只对每一种癌症的一部分病人有效果,例如在肺癌中仅对大约30%的肺癌患者有效果,如果病人的肿瘤组织为PD-L1阳性,有效率进一步提高到50%左右;而在霍奇金淋巴瘤患者中有效率接近90%,黑色素瘤有效率达40-50%,膀胱癌50%,消化道肿瘤如胃癌,食管癌和肝癌的有效率也在30%左右。
起初,研究者们认为造成这种疗效差异如此巨大的原因在于病人肿瘤组织中的PD-L1表达水平,当肿瘤组织的PD-L1表达水平低时,对于抗PD通路疗法的响应率也会相应较低,但在罗氏PD-L1抗体(Tecentriq,2016年5月18日获得FDA批准上市)在研时的一项临床试验的结果推翻了这一观点,在这个针对多种肿瘤类型的临床一期试验中,受试者被分成了四组,分别为PD-L1高表达组,PD-L1中表达组、PD-L1低表达组以及不表达PD-L1组,根据治疗结果在PD-L1高表达组中客观响应率(OR)最高,达到了46%,在中表达组和低表达组中客观响应率分别为17%和21%,在不表达PD-L1组中客观响应率也达到了13%,更有趣的是,在中位无进展生存期(mPFS)这一指标上,中表达组和低表达组的差异更小,分别为18周和17周,这一结果说明PD-L1并不能作为预后疗效判断的特异分子标记,PD-L1的表达水平不是影响抗PD通路疗法治疗效果的唯一因素。
根据进一步的研究发现,这种在同种肿瘤中相应率的差异不仅仅是与PD-L1的表达水平相关,还与病人肿瘤组织中肿瘤浸润淋巴细胞(Tumor-infiltrating Lymphocytes,TIL)的存在相关,当激活的T细胞进入肿瘤组织后,会分泌IFN-γ,上调肿瘤细胞表面PD-L1的表达,从而抗PD疗法才会发挥作用(图1)。因此,为了进一步提高抗PD通路疗法的有效性,需要在肿瘤组织切片时同时检查PD-L1和TIL的表达情况,进而根据肿瘤免疫微环境的不同特性将癌症分为四种类型,分别为T1 (B7-H1?, TIL?), T2(B7-H1+, TIL+),T3 (B7-H1?, TIL+), 和T4 (B7-H1+,TIL?) 。
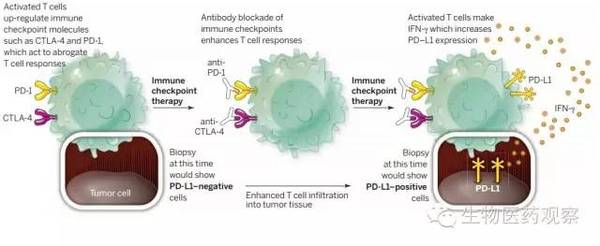
图1 肿瘤浸润淋巴细胞会上调PD-L1的表达(图片来源:参考文献2)
在这四种肿瘤分型中,T2型(图2)是针对抗PD通路疗法响应最好的一类,淋巴细胞浸润在肿瘤组中,一旦施加PD-1/PD-L1抗体,这些淋巴细胞会被激活从而杀死肿瘤,但这一类型中也有少数对于抗PD通路疗法没有相应,可能是由于存在除PD通路以外的其他抑制性通路在发挥作用,这一机制还有待阐明。
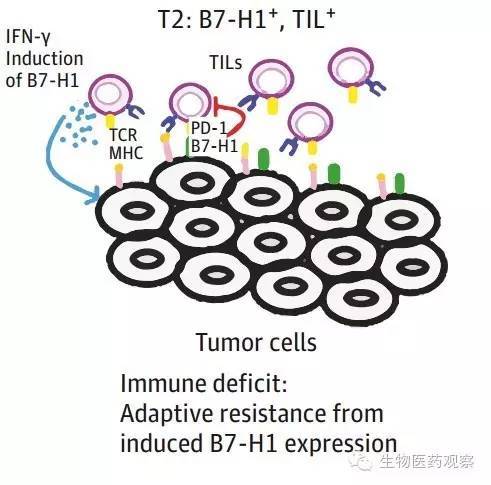
图2 T2型肿瘤是对抗PD通路疗法响应率最高的类型(图片来源:参考文献1)
T1和T4型都是对抗PD通路治疗没有响应的肿瘤类型(图3),两者都缺少TIL,唯一的区别是T4型有PD-L1表达, 针对这两种类型的肿瘤,关键在于增加肿瘤组织中的淋巴细胞浸润,据研究,CTLA-4抗体可以增加这种炎性浸润,此外还有针对共刺激分子的激活剂如4-1BB(CD137)、OX40,以及肿瘤疫苗和过继T细胞疗法都能增加TIL的积累。
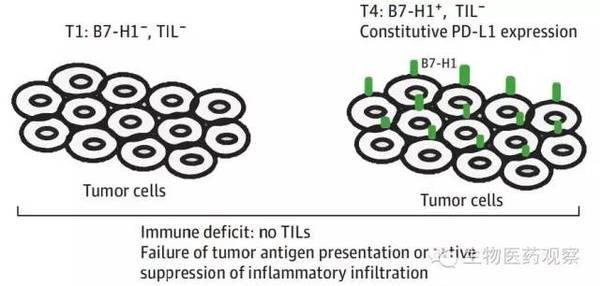
图3 T1和T4型都是对抗PD通路治疗没有响应的肿瘤类型(图片来源:参考文献1)
T3型肿瘤组织(图4)中存在TIL,但缺少PD-L1的表达,主要是由于TIL细胞功能障碍,缺少能够分泌IFN-γ的效应T细胞,造成这种细胞功能障碍的机制目前还未明了,但研究发现共刺激分子如OX40和4-1BB(CD137)激活剂可以打破肿瘤的T细胞耐受,T细胞重新被激活并分泌IFN-γ,从而上调PD-L1的表达,因此根据这种策略可以将T3型肿瘤转变成为T2型肿瘤,使得抗PD通路疗法重新发挥疗效。
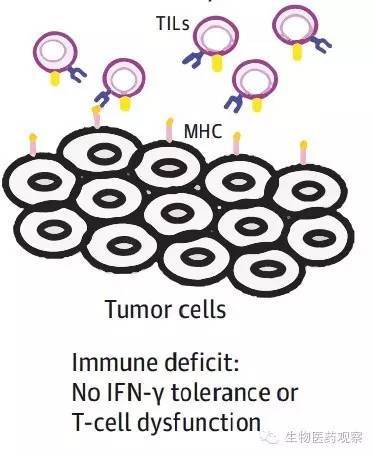
图4 T3型肿瘤组织中存在TIL但缺少PD-L1的表达(图片来源:参考文献1)
结语
人体的免疫系统是极其精密与复杂的,通过对肿瘤免疫微环境的分型可以帮助医疗工作者和药物开发者更好的了解病患的肿瘤类型,从而施以更具有针对性的治疗方案,这种分型也提示了联合治疗是未来肿瘤免疫疗法的趋势,如何利用不同的联合方案最大的激发人体自身的免疫防御机制去消灭肿瘤是未来的研究重点,肿瘤的免疫疗法研究终于迎来了黄金时代。