
人们对抗体最早的认识来自于,机体对细菌感染后的自然免疫产生的免疫应答反应。实际上,在引入疫苗接种和抗生素疗法之前,血清疗法很长时间内是抗某些细菌感染主要的疗法。使用超免疫血清进行被动免疫早在19实际末,即被Emil Behring实验室引进用来治疗白喉和破伤风。白喉棒杆菌(Corynebacterium diptheriae)和破伤风梭菌(Clostridium tetani)的类毒素免疫过的马血清会产生相应抗体,这些高烈性的毒素是白喉和破伤风主要的病原体,因此即使血清的安全性欠佳,血清疗法仍很长一段时间内,基于其高度有效性被广泛应用于白喉和破伤风的治疗。同时由于缺乏有效的破伤风疫苗和抗生素,抗血清疗法直到现在仍然在破伤风暴露后预防中具有重要作用。

当然此后血清疗法也曾应用到其他病菌感染后的治疗,例如肺炎链球菌和金黄色酿脓葡萄球菌。但是相对于白喉和破伤风,在这两个病原体中血清疗法的疗效极为有限,这一方面与更为复杂的疾病发病机理有关,另一方面跟病原体的异质性有关。其他感染性疾病方面,随着20世纪40年代以青霉素为代表的抗生素的发现,抗菌血清疗法被逐渐放弃。
抗生素药物经过半个世纪的快速发展以来,绝大部分病菌感染疾病都得到了有效地控制。然而,一方面人们却越来越认识到对某些细菌感染,可能抗生素疗法并不能进行有效治疗。另一方面,随着抗生素进一步被滥用,超级细菌的出现,使感染性的疾病再度引起了人们的关注。
人们逐渐意识到应对这一感染类疾病的武器越来有限,越来越少。最简单的往往是最有效地,在抗血清疗法被废止后的半个世纪后,再度回到人们的视野。而过去三十年中,世界制药版图发生了翻天覆地的变化,以单克隆抗体为代表的大分子药物在癌症、自身免疫性疾病和心血管等多个领域得到广泛地应用。针对感染类疾病,抗体药物再度回归,又将以怎样新的方式应用到感染类的疾病?本文初步介绍抗体药物在感染类疾病中的应用现状及未来。
抗生素耐药已经成为一个世界性的卫生问题。世界范围内新的耐药菌不断出现,既有耐药菌耐药程度加剧,伴随当下抗生素研发步伐放缓,临床上面临的抗菌治疗日趋严峻,甚至出现"无药可用"的情况。美国感染病学会的抗生素效益评估小组经调查后认为屎肠球菌(Enterococcus faecium)、金黄色葡萄球菌(Staphylococcus aureus)、肺炎克雷伯菌(Klebsiella pneumoniae)、鲍氏不动杆菌(Acinetobacter baumannii)、铜绿假单胞菌( Pseudomonas aeruginosa)及肠杆菌属(Enterobacterspecies)等6类细菌耐药情况极度严峻,取其各自拉丁文名称首字母而简称ESKAPE。
可幸的是,对其中的某些细菌而言,可溶性的毒素是它们主要的病原体,因此这类疾病相关单抗药物的开发至少有以下三个优势:1、毒素类细菌的感染方式更为烈性,毒素中和型的临床前模型更容易被建立;2、抗生素虽然可以杀灭毒素产生的细菌,但剩余存在的毒素仍然会使疾病进一步恶化,而抗体类药物则可以彻底清除这些毒素;3、抗生素疗法可能会进一步恶化毒素介导的疾病,一方面抗生素引起细菌裂解,释放的毒素可能会进一步提高致病因子的浓度。另一方面细菌体内激活的压力应答反应会进一步提高毒素基因的转录水平。因此,在这些毒素类感染疾病中,单抗药物具有较大的治疗优势。
炭疽杆菌(Bacillus anthracis)
芽孢杆菌属的炭疽杆菌(Bacillus anthracis)是引起某些家畜和人类炭疽病(人畜共患)的病原菌。炭疽杆菌的荚膜和产生的毒素是主要的致病因素。荚膜由D-谷氨酸多肽组成,能抑制抗体和抵抗吞噬细胞的吞噬作用,促进该菌入侵后扩张繁殖。其毒素可增加微血管的通透性,改变血液正常循环,损害肝脏功能,干扰糖代谢,最后可导致死亡。2001年,炭疽杆菌在美国的入侵一度使暴露后预防的医疗需求被放大。
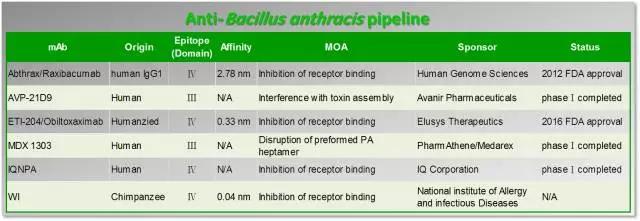
炭疽杆菌的抗原组成有荚膜抗原、菌体抗原、保护性抗原及芽胞抗原4种。荚膜抗原是一种多肽,能抑制调理作用,与细菌的侵袭力有关,也能抗吞噬,有利于细菌的生长和扩散;菌体抗原虽无毒性,但具有特异性;保护性抗原具有很强的免疫原性;芽胞抗原有免疫原性及血清学诊断价值。炭疽杆菌繁殖体能分泌炭疽毒素,此毒素由第I因子(水肿因子,EF)、第Ⅱ因子 (保护性抗原,protectiveantigen ,PA)及第Ⅲ因子 (致死因子,LF)所组成的复合多聚体。3种成分个别注人动物体内均无毒性,但保护性抗原加水肿因子或致死因子则可分别引起水肿、坏死或动物死亡。保护性抗原PA是炭疽毒素的受体结合最重要的部件,是最常见的靶点,其晶体结构在1997年被解析出。PA为pag基因编码的83 kD的蛋白,此蛋白由四个结构域,区域一有EF和LF结合的位点,区域二形成微孔,区域三为寡聚体,区域四与细胞表面炭疽素受体结合。目前有六个针对PA的单抗药物进行开发,其中四个结合区域四,两个结合区域三。2012年和2016年先后被FDA批准的Raxibacumab和Obiltoxaximab均是结合PA结构域四的。
FDA的动物法则允许在人类中开展充分控制疗效研究不可行或不道德的情况下,采用来自充分的良好对照的动物研究数据来支持批准产品上市。Obiltoxaximab的获批,是基于动物试验的疗效数据及人体安全性研究数据。动物试验表明,与安慰剂组相比,Obiltoxaximab注射治疗的动物组有更高比例的动物存活,Obiltoxaximab联合其他抗菌药物可提高生存结局。另外,该药物也在320名健康志愿者中进行了安全性评估,研究中最常报道的副作用包括头痛、瘙痒、上呼吸道感染、咳嗽、鼻塞、荨麻疹,以及注射部位出现青紫、肿胀和疼痛。
难辨梭菌(C.difficile)
难辨梭菌(C.difficile)是一种革兰氏阳性菌,是临床期间抗生素相关性腹泻的主要病原体。临床艰难梭菌感染病情严重、复发率高,是后抗生素时代十分棘手的问题,感染发生率在过去的20年间急速上升。仅2011年一年,美国艰难梭状芽孢杆菌感染病例数近五十万,死亡人数29000人,其中80%为65岁以上的老人。死亡多在首次确诊30天内发生。同时随着高烈性菌株的出现,这一情况变得更为严峻。
经过多年的研究发现,这一疾病的主要病因是由于肠道被难辨梭菌感染后,产生的两种毒素A和B导致的。两种毒素中都具有细胞毒性,但B的毒性更强,同时A也是一种肠毒素。毒素B能破坏肠壁,引起炎症,随后引发艰难梭状芽孢杆菌特有的临床症状,包括腹痛和水性腹泻。老年人,以及由于潜在疾病或治疗而处于免疫受损状态的病人会遭受更大的影响。然而,目前为止,艰难梭状芽孢杆菌感染尚无获得批准的有效治疗方法,标准治疗方式为万古霉素或甲硝唑,反复发作是艰难梭状芽孢杆菌的一个最主要的问题,约1/4的患者在初次感染后经历复发,而这些人群中又有40%会遭遇进一步的复发。
目前,有两项关于难辨梭菌(C.difficile)全人单抗药物进入临床,分别为抗toxin A的Actoxumab,抗toxin B的Bezlotoxumab,它们均是由Massachusetts BiologicLaboratories/Medarex/Merck联合开发的。两款药物的开发可谓历经艰难,早些时候Merck递交Bezlotoxumab的BLA申请,FDA授予其优先审评资格,美国抗菌药物咨询委员会在2016年06月09日召开会议,以10比5的投票支持其用于难辨梭菌感染(Clostridium difficile infection)复发后治疗,并确定其的PDUFA时间为2016.07.23。但是,随后FDA要求Merck递交更多有关Bezlotoxumab的安全性和有效性数据,所以将其PDUFA时间推迟至2016.10.23。Bezlotoxumab的BLA申请的临床数据由两项Ⅱ期临床和两项Ⅲ期临床构成。两项Ⅱ期临床中,P018单独评估了Actoxumab效果,而P017评估Actoxumab和Bezlotoxumab的联用效果,但却没有单独评估Bezlotoxumab的效果。
两项Ⅲ期临床中,P001在包含了来自19个国家的1452名患者中进行时一项四臂临床考察(Bezlotoxumab单用、Actoxumab单用、Bezlotoxumab和Actoxumab联用、安慰剂),在包含17个国家的1203名患者中进行了一项三臂临床考察(Bezlotoxumab单用、Bezlotoxumab和Actoxumab联用、安慰剂)。结果显示获得Bezlotoxumab或Bezlotoxumab和actoxumab联用的感染复发率均显著低于安慰剂组。效用持续时间长达12周。基于以上数据,默克选择Bezlotoxumab申请市场授权。该项目的首席研究员,来自英国利兹大学的Mark Wilcox博士评论道,Bezlotoxumab的临床治疗效果显著优于目前艰难梭状芽孢杆菌感染标准治疗流程的病人。但很显然,FDA对Bezlotoxumab临床数据并不是完全认可,对临床试验的严谨性和数据分析提出了质疑,因此推迟了其PDUFA时间,要求其对Bezlotoxumab的临床数据进行进一步的分析。小编后续将详细介绍Bezlotoxumab的开发申报历程。
金黄色葡萄球菌(S.aureus)
金黄色葡萄球菌(S.aureus)是葡萄球菌属的一种革兰氏阳性菌,具有高度抗药性,是人类化脓感染中最常见的病原菌。它可引起局部化脓感染,也可引起肺炎、伪膜性肠炎、心包炎等,甚至败血症、脓毒症等全身感染。金黄色葡萄球菌的致病力强弱主要取决于其产生的毒素和侵袭性酶。新出现的耐甲氧西林金黄色葡萄球菌,被称作超级细菌,几乎能抵抗人类所有的药物,只有万古霉素对其有所疗效。
金黄色葡萄球菌的致病因子繁多,从表面黏附因子、毒素到酶蛋白等一系列的结构物质,给金黄色葡萄球菌的防治带来了极大的挑战。

凝聚因子(clumping factor A,ClfA)是金黄色葡萄球菌表面的一种蛋白,通过和纤维蛋白或纤维蛋白原的结合,是介导宿主感染的主要组件。基于ClfA对于金黄色葡萄球菌感染的重要性,其成为最常见的靶点。Inhibitex开发的人源化IgG1抗体Tefibazumab是最早进入临床的ClfA抗体。但在2005-2006年期间,进行的一项Tefibazumab和抗生素联用的Ⅱ期临床试验并没有显示有效性。Neutec开发的单抗Aurograb是靶向金黄色葡萄球菌表面蛋白GrfA,GrfA属于ABC转运蛋白家族的,跟病菌感染过程息息相关。Aurograb在2004-2006年进入临床Ⅲ期,和万古霉素联用于抗金黄色葡萄球菌的治疗,但同样并未显示出有效性。
其它几个产品MEDI4893、Salvecin和514G3在前期的试验中数据较为良好,目前都处在临床Ⅱ期阶段,值得期待。同时,随着近两年来双特异性抗体的ADC药物的快速发展,ASN100和AAC虽然处在临床前期,但是同样潜力无穷。
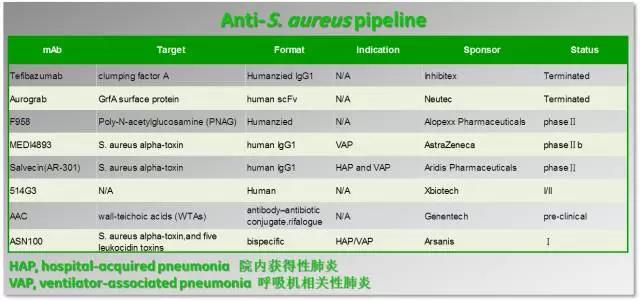
ASN100是Arsanis开发的一种双特异性抗体,可以同时结合6个金黄色葡萄球菌毒素。其中一侧抗体ASN-1可以结合5个毒素(1个alpha-toxin和4个leukocidin toxins)共同的一个抗原表位,另一侧的抗体ASN-2可以结合第5个抗原表位并不重叠的leukocidin toxins,该产品目前在欧洲和美国同时在进行Ⅱ期临床试验,两个抗体ASN-1和ASN-2的单独临床前数据近期分别发表在《Antimicrobial Agents and Chemotherapy》和《mAbs 》上。
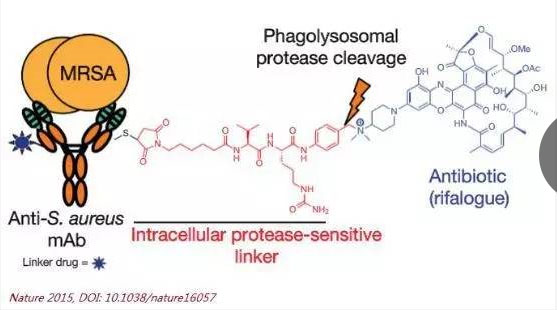
2015年底,Genentech一项抗体-抗生素缀合物(antibody–antibioticconjugate)的技术发表在《Nature》上,他们从四十多种抗金黄色葡萄球菌的抗体中,选取了一株靶向菌体表面磷壁酸(teichoic acids)的抗体,和利福霉素衍生物抗生素rifalogue连接起来得到AACs。这种非活性的AACs能够在金黄色葡萄球菌侵入宿主免疫细胞之前就附着到病菌表面,抗体一旦出现在宿主细胞内,细胞内的蛋白酶就会切断连接分子,释放出AACs中的抗生素,从而杀死病菌。临床前试验表明,与标准万古霉素(抗生素)疗法相比,在小鼠体内的AACs清除金黄色葡萄球菌的效果要好很多。
绿脓杆菌(P.aeruginosa)
绿脓杆菌(P.aeruginosa)或称铜绿色假单胞菌,是一种致病力较低但抗药性强的杆菌。绿脓杆菌感染可发生在人体任何部位和组织、常见于烧伤或创伤部位、中耳、角膜、尿道和呼吸道。也可引起心内膜炎、胃肠炎、脓胸甚至败血症。在住院患者及免疫功能受损的群体中可引发严重感染。绿脓杆菌是从住院时间超过一周的患者中分离到的最常见的病原体,同时也是导致医院内感染的最常见原因。据估计,在美国,每年发生5.1万例绿脓杆菌感染,在人工气道机械通气的患者中,绿脓杆菌的检出率高达24%,耐药菌株中所观察到的致死率高达43%。
绿脓杆菌能产生多种与毒力有关的物质,如内毒素、外毒素a、弹性蛋白酶、胶原酶、胰肽酶等,其中以外毒素a最为重要。绿脓杆菌外毒素a为一种热不稳定的单链多肽,分子量约66,000,经甲醛或戊二醛处理可脱毒为类毒素,并被特异性抗毒素中和。毒性强,注入动物后,主要靶器官肝脏可出现细胞肿胀、脂肪变性及坏死;其他脏器病变有肺出血和肾脏坏死。外毒素a机理与白喉毒素有些类似,即最终使核糖体上延长因子2(ef~2)失活,抑制宿主细胞的蛋白质合成,但具体过程不同。此外,外毒素a和白喉毒素在蛋白质结构、免疫原性、鞭细胞和敏感动物等方面均有差异。
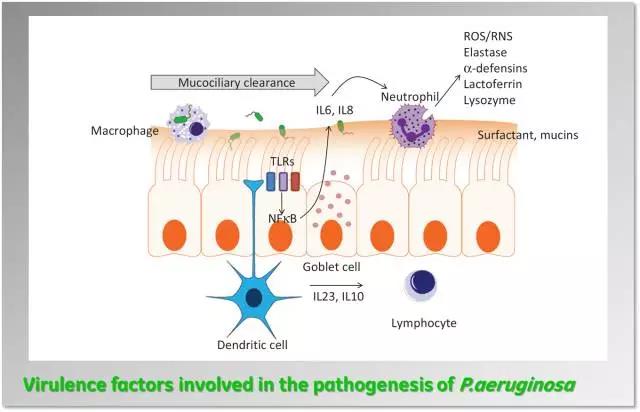
铜绿假单胞茵Ⅲ性分泌毒素PcrV是调控其感染的关键因子之一。KaloBios Pharma开发的KB001-A是靶向PcrV的PEG化Fab抗体,用于绿脓杆菌引起的囊性纤维化的治疗,但2015年公布一项Ⅱ期临床结果显示,其并未达到首要终点,随后KaloBios Pharma终止该项目的研发。

Aridis Pharmaceuticals开发的Panobacumab是靶向绿脓杆菌脂多糖(lipopolysaccharides,LPS)O11亚型的IgM抗体。在一项Ⅱ期临床试验中,在18种高危性HAP 和VAP患者中和抗生素联用考察了其有效性,并达到了首要终点,目前在美国和欧洲均得到孤儿药授权。Aridis Pharmaceuticals一直致力于抗菌类抗体药物的开发,目前他们也开发了绿脓杆菌脂多糖serO1和serO6型的抗体,预计等Panobacumab上市后,将联合开展鸡尾酒疗法。
AstraZeneca的MEDI3902是抗绿脓杆菌单抗类药物中最引人注目的,它也是一种双特异性抗体,可以同时靶向Psl和PcrV。对Psl具有稍低的亲和力,由于Psl广泛表达于细菌的表面,所以可以抗体更容易接近绿脓杆菌。而对PcrV更高的亲和力,使MEDI3902更有效地执行抗体相关功能。临床前结果表明,无论在原始病株还是突变病株中,MEDI3902(BiS4apa)都具有极强的抗菌作用。
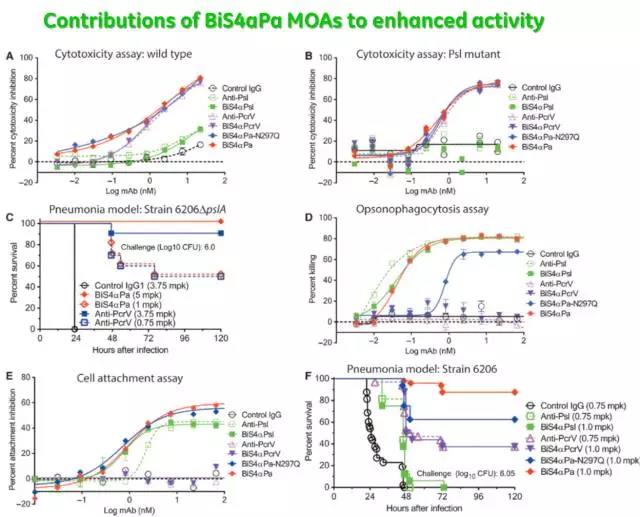
2014年,FDA已授予MEDI3902快车道地位(Fast Track designation),用于预防由绿脓杆菌导致的医院获得性肺炎(nosocomial pneumonia,NP),目前正在Ⅱ期临床试验研发阶段。
其他抗菌类单抗
此外肉毒毒素(botulinum toxin,AX)也属于一种最严重(A级)的生物毒素。和炭疽杆菌一样,过去十年针对其也开发了大量的治疗性抗体。但直到2011年,才有第一项研究NCT01357213进入临床阶段。由三个IgG1抗体(NX01、NX02、NX11)组成的鸡尾酒疗法XOMA 3AB,可以靶向A型肉毒杆菌毒素的四个亚型(A1、A2、A3、A4),联用情况下对抗原亲和力达到了18 pM,比单个使用情况下提高了400倍。
胃部被产生志贺毒素(Shiga toxin)的大肠杆菌感染(STEC)感染后,会引起溶血尿毒症综合征(hemolytic uremic syndrome,HUS),是一种严重的毒素介导疾病。两种形式的Shiga toxin和HUS有关:Stx1和Stx2。Thallion Pharmaceuticals研发的一种鸡尾酒疗法Shigamabs,由两种分别抗Stx1和Stx2的人源化抗体cαStx1and cαStx2组成。目前已在儿童HUS中进入II期阶段,在EMA和FDA均进入孤儿药审批流程。
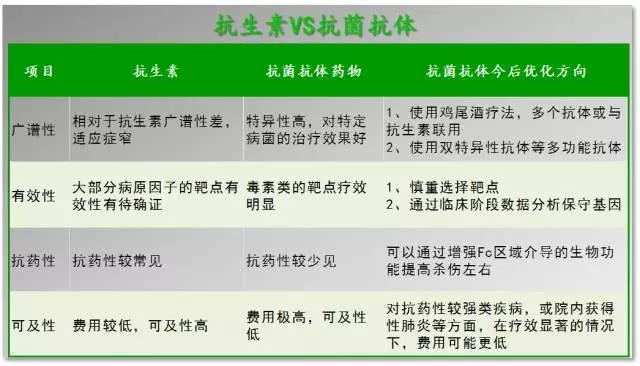
自上世纪40年代发现抗生素以来,感染类的疾病逐步被人类控制。但是随着更多耐药性“超级细菌”的出现,部分疾病出现了无药可治的局面,所以无论是抗生素还是其他抗菌类药物又重新回到各大药厂的研发管线中。在过去几十年中,单抗药物得到了快速发展,在抗癌、抗炎症和抗病毒治疗中得到广泛应用。但是抗菌类抗体药物才刚刚起步,虽然人们仍然对其广谱性和费用持一定怀疑态度,但其已在特定疾病表现出诸多的优势。目前FDA共批准两个抗菌类抗体药物,一个正在BLA。相信随着更多抗菌类抗体药物上市,这一类药物将得到更多的重视,小编也将持续关注该类药物的发展,进行后续报道。
参考资料:
[1] Antibacterial antibodies gaintraction
[2] Anti-bacterial monoclonalantibodies: Back to the future?
[3] Staphylococcus aureus virulencefactors and disease
[4] Two-hit antibody tackles bacteria
[5] Pseudomonas aeruginosa: new insightsinto pathogenesis and host defenses
[6] Staphylococcus aureus virulencefactors and disease
[7] Novel antibody–antibioticconjugate eliminates intracellular S. aureus
[8] A multifunctional bispecificantibody protects against Pseudomonas aeruginosa