
神经胶质瘤简称胶质瘤,是发生于神经外胚层的肿瘤。胶质瘤的种类,以星形细胞瘤最多,其次为胶质母细胞瘤,好发部位多见于脑部,如星形细胞瘤成人多见于大脑半球,儿童则多发在小脑;胶质母细胞瘤几乎均发生于大脑半球;髓母细胞瘤发生于小脑蚓部;室管膜瘤多见于第4脑室;少枝胶质瘤大多发生于在脑半球。脑胶质瘤是最常见的颅内肿瘤,约占所有颅内肿瘤的45%左右。在儿童恶性肿瘤中排第二位,近30年来,原发性恶性脑肿瘤发生率逐年递增,年增长率约为1.2%,中老年人群尤为明显。据文献报道,中国脑胶质瘤年发病率为3-6人/10万人,年死亡人数达3万人。胶质瘤系浸润性生长物,它和正常脑组织没有明显界限,难以完全切除,对放疗化疗不甚敏感,非常容易复发,生长在大脑等重要部位的良、恶性肿瘤,手术难以切除或根本不能手术。化学药物和一般抗肿瘤的中药,因血脑屏障等因素的影响,疗效也不理想,因此脑胶质瘤至今仍是全身肿瘤中预后最差的肿瘤之一。
2007年世界卫生组织(WHO)根据肿瘤的恶性程度将胶质瘤分为四级,Ⅰ级胶质瘤预后最好,大部分可达到临床治愈,故被认为是良性肿瘤,其余均为恶性肿瘤;Ⅱ级胶质瘤被认为是低级别恶性肿瘤,具有部分间变细胞、有丝分裂活性较弱,但是有进展为高度恶性肿瘤的潜能;与Ⅱ级胶质瘤相比,Ⅲ级胶质瘤具有较高的间变型和较强的有丝分裂活性,且生存期明显低于Ⅱ级胶质瘤;恶性程度最高的为Ⅳ级星形细胞瘤即胶质母细胞瘤(glioblastoma Multiforme,GBM,Grade IV),也是俗称的脑癌。
肿瘤的发生被认为是由关键基因发生遗传改变或体突变而引起的,这些遗传改变或基因突变随着时间的累积会导致异常细胞群的出现,最终形成肿瘤。所有的星形细胞胶质瘤中,以GBM的基因突变为最多,且大多数患者同时有多个基因发生突变。GBM中最常见的基因突变包括:
杂合子缺失,染色体臂10q缺失是最常见的基因突变,约占60-90%;
位于17号染色体的抑癌基因P53的突变,发生率约为25-40%,多见于继发性GBM;
位于7号染色体编码表皮生长因子(EGF)的癌基因EGFR的过表达,主要见于原发性GBM,发生率为40-50%;
位于19号染色体的细胞周期抑制基因p16,发生率为30-40%;
位于10号染色体的PTEN(phosphatase and tensin homolog),发生率为30%;此外还有p16INK4A和视网膜母细胞瘤(retinoblast-oma,RB)基因的突变。
GBM中常见发生基因突变的三条主要信号通路:酪氨酸激酶受体RTK/RAS/PI3K,p53信号通路和RB信号通路。
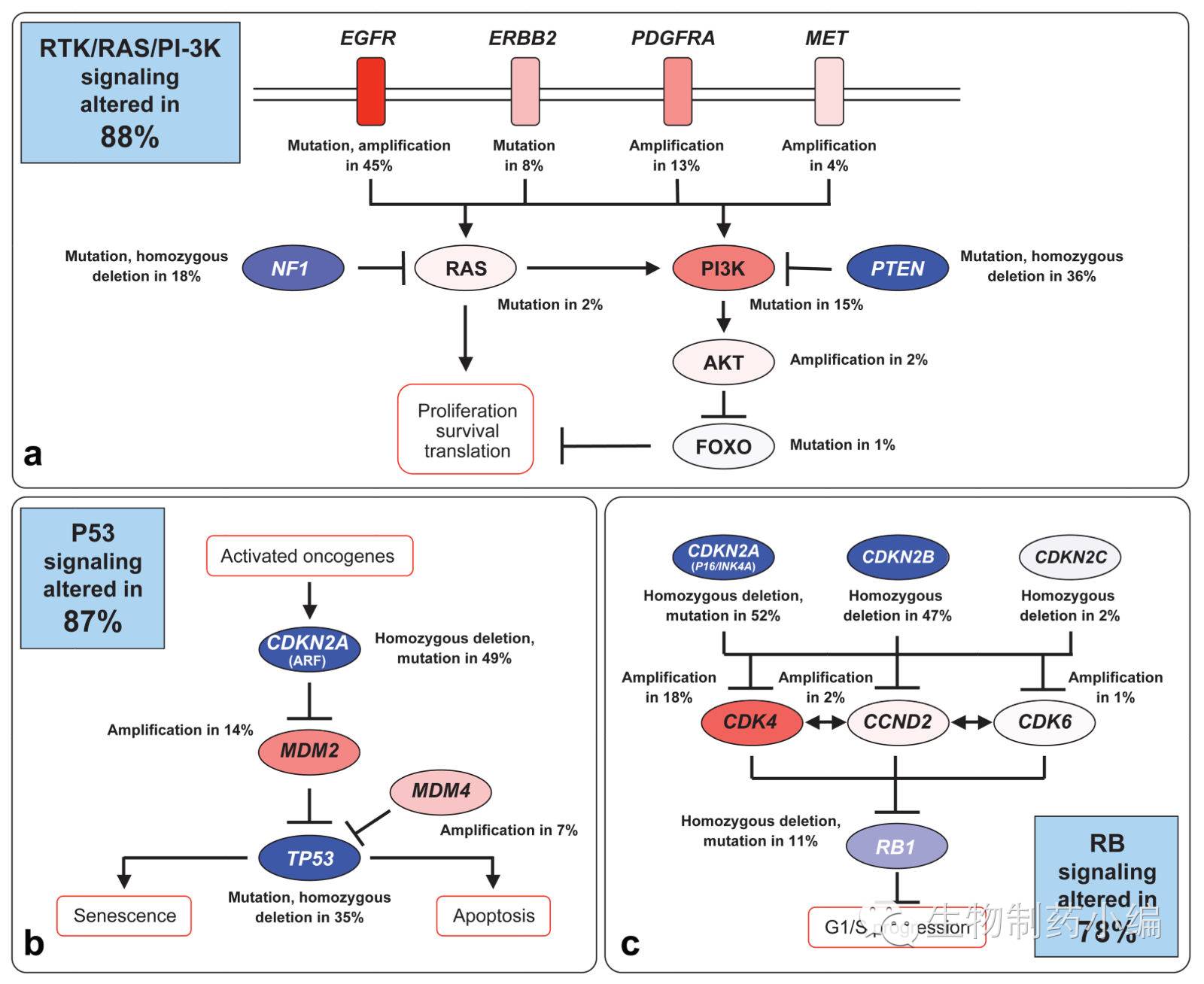
▲红色:活化的基因改变;蓝色:基因功能缺失
相对于p53和RB通路功能失活难以靶向,目前靶向治疗策略是特异性针对功能获得性RTK/RAS/PI3K信号通路中分子靶点,如EGFR、VEGF及mTOR等。已有靶向抑制VEGF的Avastin,以整合素(Integrin)为靶点的西仑吉肽(Cilengitide)和作用于EGFR的吉非替尼(Gefitinib)等多种单抗及小分子抑制剂,应用于大规模恶性脑胶质瘤患者的临床治疗试验。其中Avastin已获得美国FDA批准上市,用于治疗复发GBM患者。另外,治疗策略还包括微环境的改变,包括血管生成、干细胞样癌细胞通路、疫苗和免疫检查点的调节等,除此以外,治疗还必须越过血脑屏障接近肿瘤。
化疗药物
替莫唑胺(TMZ):作为一种新型咪唑四嗪类烷化剂,容易进入血脑屏障,在脑组织内的浓度可达血液浓度的30%~40%,成为胶质瘤化疗进展的“里程碑”,已成为临床上治疗恶性胶质瘤的一线化疗药物,于1999年8月11日通过FDA批准上市。国内目前有三种上市药品,包括天士力集团的“蒂清”,默沙东的“泰道”和北京双鹭药业的“交宁”。TMZ作用机制主要是通过对DNA中鸟嘌呤的O6和N7位置上的烷化作用而诱发细胞的凋亡,而肿瘤细胞内的O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguaine-DNA-methyltransferase,MGMT)可使DNA烷基化,特别是甲基化损伤得到修复,因此使药物的毒性降低。约有超过50%的患者通过MGMT对TMZ产生耐药性。
靶向药物
依维莫司:依维莫司是针对mTOR信号通路蛋白表达的抑制剂。2010年10月,FDA加速批准依维莫司(everolimus,商品名Afinitor)用于无法手术治疗的结节性硬化症(TS)相关的室管膜下巨细胞星形细胞瘤(SEGA)。2012年8月,FDA又批准了儿科专用剂型的依维莫司口服混悬液片(Afinitor Disperz)用于治疗≥1岁结节性硬化症患者的不能手术切除的室管膜下巨细胞星形细胞瘤。
阿瓦斯汀Avastin:2009年,Avastin在恶性神经胶质瘤二线治疗阶段获得FDA加速审批,用于术后复发、放射及替莫唑胺治疗失败的恶性胶质瘤。该审批基于两个单臂的II期临床数据:Avastin在术后复发、放射及替莫唑胺治疗失败的神经胶质瘤病人中取得了25.9%的ORR;4.2月的PFS;8.2月的OS及36%的6个月PFS率,这些数据均明显优于历史对照。但是III期临床试验显示PFS优势虽然明显,但OS没有优势,即Avastin并不能延长新发恶性胶质瘤患者的生命。因此Avastin针对恶性神经胶质瘤一线治疗的新药申请并未被批准。
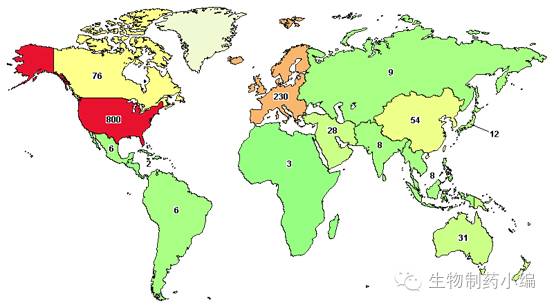
目前,在临床阶段的胶质瘤治疗项目繁多,在clinicaltrials.gov中搜索glioblastoma有1144个结果,从地域分布来看主要集中于北美和欧洲。本文主要关注GBM的生物药物疗法。
靶向疗法
参与GBM形成的多种分子基因表型及信号转导通路的鉴定使许多靶向药物包括VEGF单抗,EGFR TKIs(gefitib and erlotinib),抗血管生成药物(bevacizumab,enzastaurin),mTOR抑制剂(temsirolimus, 坦罗莫司,everolimus依维莫司)和整合素抑制剂(clilengitide西仑吉肽)等正在进行临床评价。目前大多数药物对GBM尚未显示出显著的疗效,仍有待于大规模随机对照临床研究来验证。对GBM进行精确的分子生物学特点检测,并且根据每个患者的基因特点制定个体化的治疗方案或许是靶向治疗的方向,然而,胶质瘤有成千上万的分子突变,这些突变构成了极其复杂的动态网络,哪些是核心靶点?不同分子通道间具有互补性,如果把一条通道抑制住后,另外一条通道又起来了;而且脑胶质瘤细胞存在时间和空间的异质性,三年前的肿瘤和三年后的肿瘤是不一样的,即使同一个时间点,不同的区域的突变也是不一样的。因此对于脑胶质瘤治疗而言,精准治疗还是个概念,有待实现。
此外,胶质瘤干细胞(GSC)在胶质瘤的发生、进展、抵抗放化疗和复发等过程中起重要作用,针对GSC中关键信号通路的靶向治疗具有较大的潜力,如靶向抑制GSC中Notch、Hedgehog及Wnt/Beta-catenin等胚胎信号通路位靶点,或许可以成为胶质瘤新兴的治疗方法。
免疫疗法
免疫疗法被认为是继手术、放疗、化疗、靶向治疗后第五类肿瘤治疗技术,越来越显示出其临床的优秀效果。传统认为中枢神经系统(CNS)是“免疫豁免区”,但近年来发现CNS中存在免疫功能,胶质瘤本身具有多种免疫逃逸的机制,所以免疫疗法的策略是通过各种手段增强免疫系统对胶质瘤细胞的靶向作用,比如将肿瘤抗原、蛋白、多肽等抗原先致敏DCs然后输入,抗体免疫治疗以及过继免疫治疗等。
肿瘤疫苗
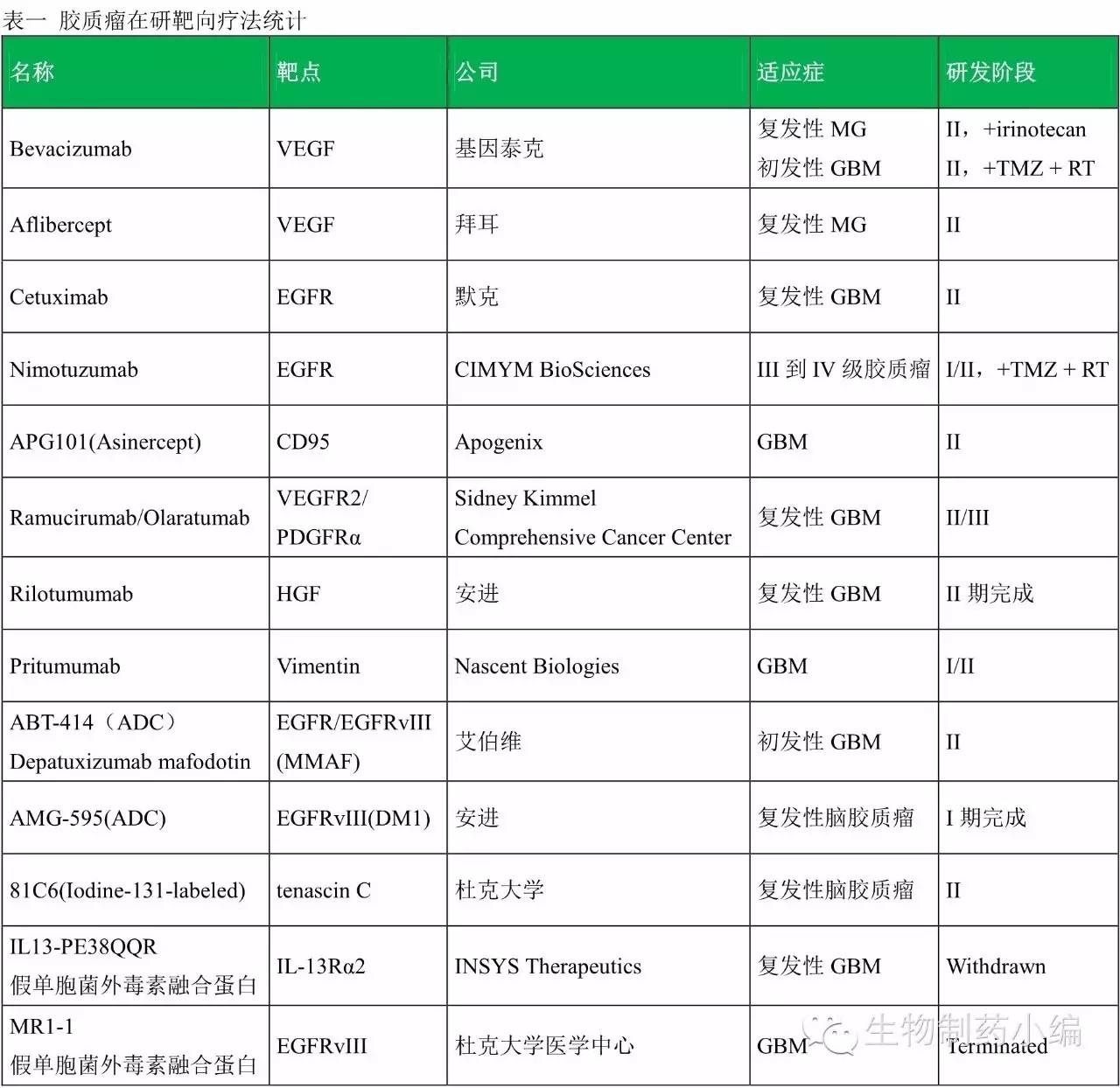
肿瘤疫苗最为关注的为Rindopepimut。Rindopepimut(Rintega,CDX-110)是美国Celldex公司针对肿瘤靶向特异性分子EGFRvIII的试验免疫治疗疫苗,I期和II期都表明Rindopepimut在EGFRvIII过表达GBM患者中具有高效刺激抗肿瘤免疫的功效,能延长患者的生产时间。所以Rindopepimut一度被认为是GBM的破冰疗法。然而,2016年3月7日Celldex宣布Rindopepimut的关键III期临床试验因未能改善总生存期而提前终止。在治疗性肿瘤疫苗之路上已有Dendreon与Celldex相继倒下,谁会成为第一个幸运儿,唯有翘首以盼。
另一个值得关注的是DCVax-L。DCVax-L与其说是一种药,不如说是一种个体化的治疗手段:首先从病人血液中提取干细胞培养成树状细胞,然后手术将肿瘤切除,取出部分肿瘤组织,将其呈递给前述的树状细胞来识别肿瘤特异蛋白抗原,装载肿瘤抗原的树状细胞重新被注入到病人的淋巴结内,树状细胞将肿瘤抗原呈递给T细胞和B细胞,产生免疫记忆,这样病人体内一旦再产生癌细胞,体内的免疫系统会迅速做出反应,立即清除癌细胞防止复发。DCVax-L的前景被看好,福布斯的分析人士认为此药有40%以上机会上市(对于癌症疫苗来说已经相当大了),而Fierce Biotech更是将其列为全球15大后期重磅管线药物之一,预测此疫苗2020年销售额将超过20亿美元。

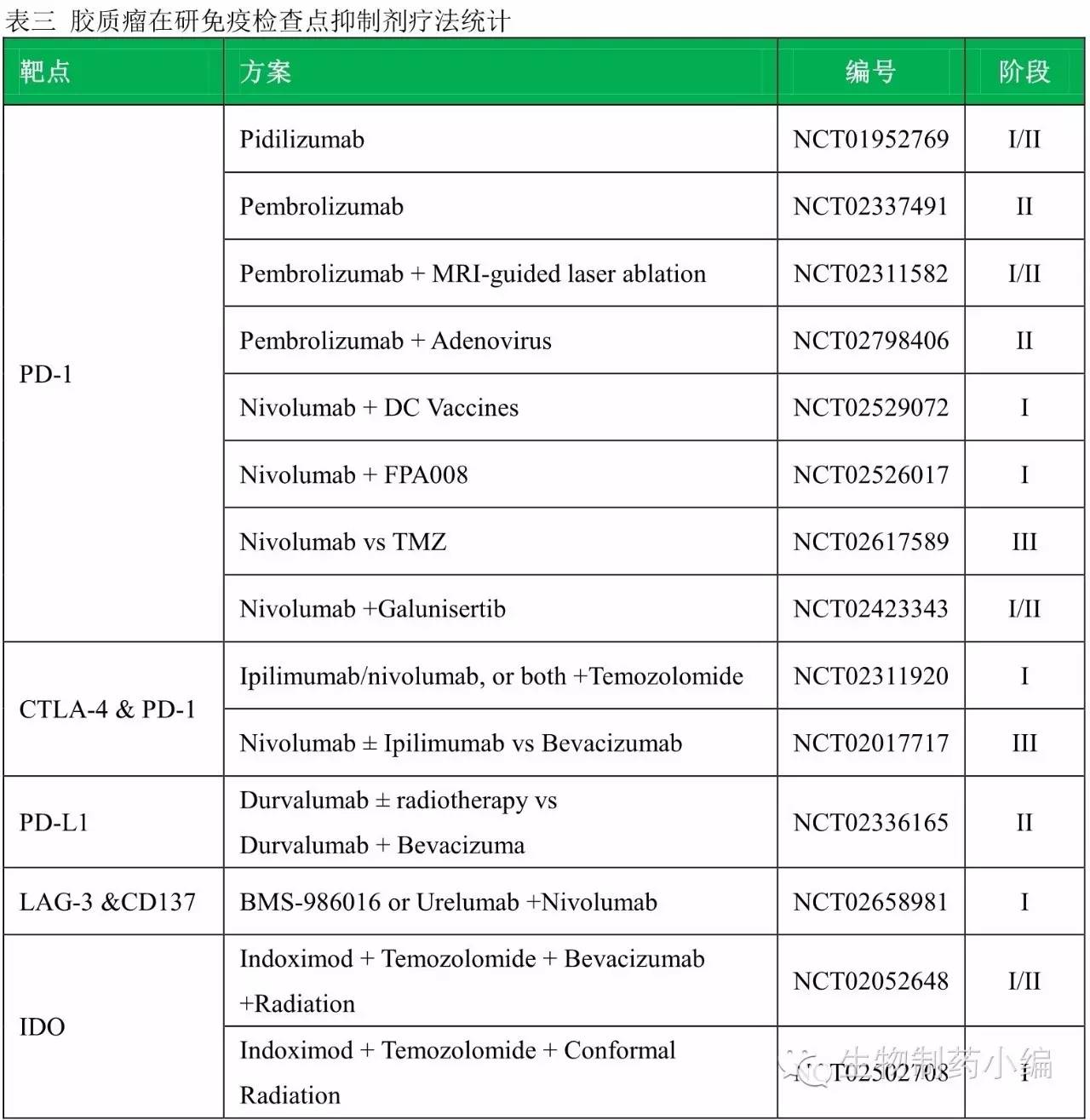
免疫检查点
除了细胞信号和生长因子的突变之外,部分GBM的侵袭性与其可逃逸免疫系统的监控有关,介导免疫系统逃逸的重要蛋白包括CTLA4,PD1及LAG3等。免疫检查点抑制剂在治疗黑素瘤、肺癌和肾癌时已经显示出显著的活性,这使得人们对治疗恶性胶质瘤也有很大的期待。与免疫检查点相关的临床试验目前已有多项在开展中。不同病理类型的胶质瘤,PD1的表达水平也不一样,星形细胞瘤患者外周血CD4+T细胞PD1表达的比例要明显高于其他胶质瘤,胶质母细胞瘤外周血CD4+和CD8+T细胞表面PD1表达水平被证明是提高最为明显的类型,PD-L1的表达率约为70~88%。然而PD-L1的表达与否与表达水平的高低与患者的预后无统计学意义
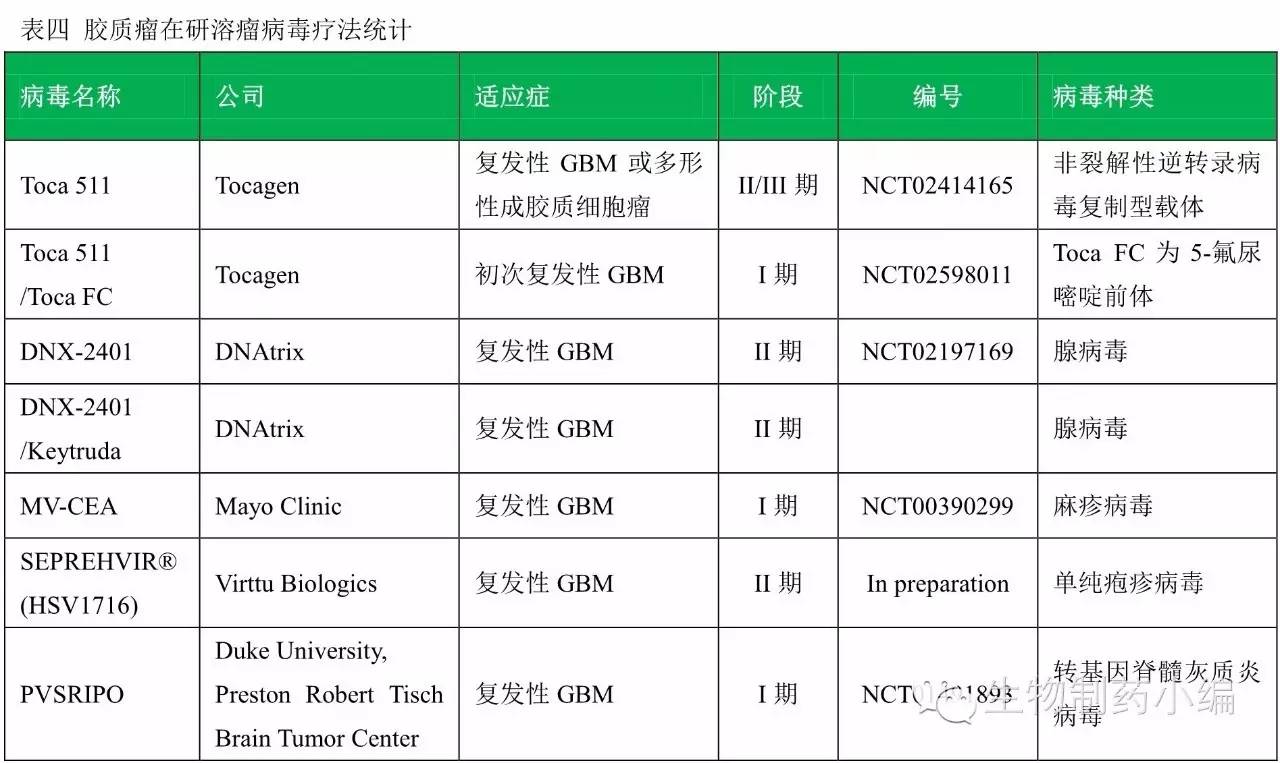
溶瘤病毒疗法
溶瘤病毒疗法,即以毒攻毒,用最凶狠的病毒去攻击最恶性的肿瘤。Tocagen公司在该领域走在最前面。Tocagen公司的治疗方法属于Toca 511和Toca FC联合两步治疗法,Toca 511可将胞嘧啶脱氨酶(CD)的基因选择性地递送入癌细胞,Toca FC是一种口服的抗真菌药物。肿瘤细胞内表达的CD基因可以将Toca FC转化为抗癌药物5-氟尿嘧啶(5-FU),进而介导肿瘤细胞程序性死亡,并增强机体对肿瘤的免疫应答。该联合疗法获得FDA加速审评资格以及孤儿药的地位。Tocagen公司不但治疗思路独特,其勇气也可嘉。Toca 511和Toca FC联合疗法直接进入几乎最难的肿瘤领域恶性脑胶质瘤。另外,Tocagen的自信心也很强大,其宣传标语为“no one should die of cancer”,初见时的震惊不亚于MDAnderson老大刚上任时打出的口号“making cancer history。”
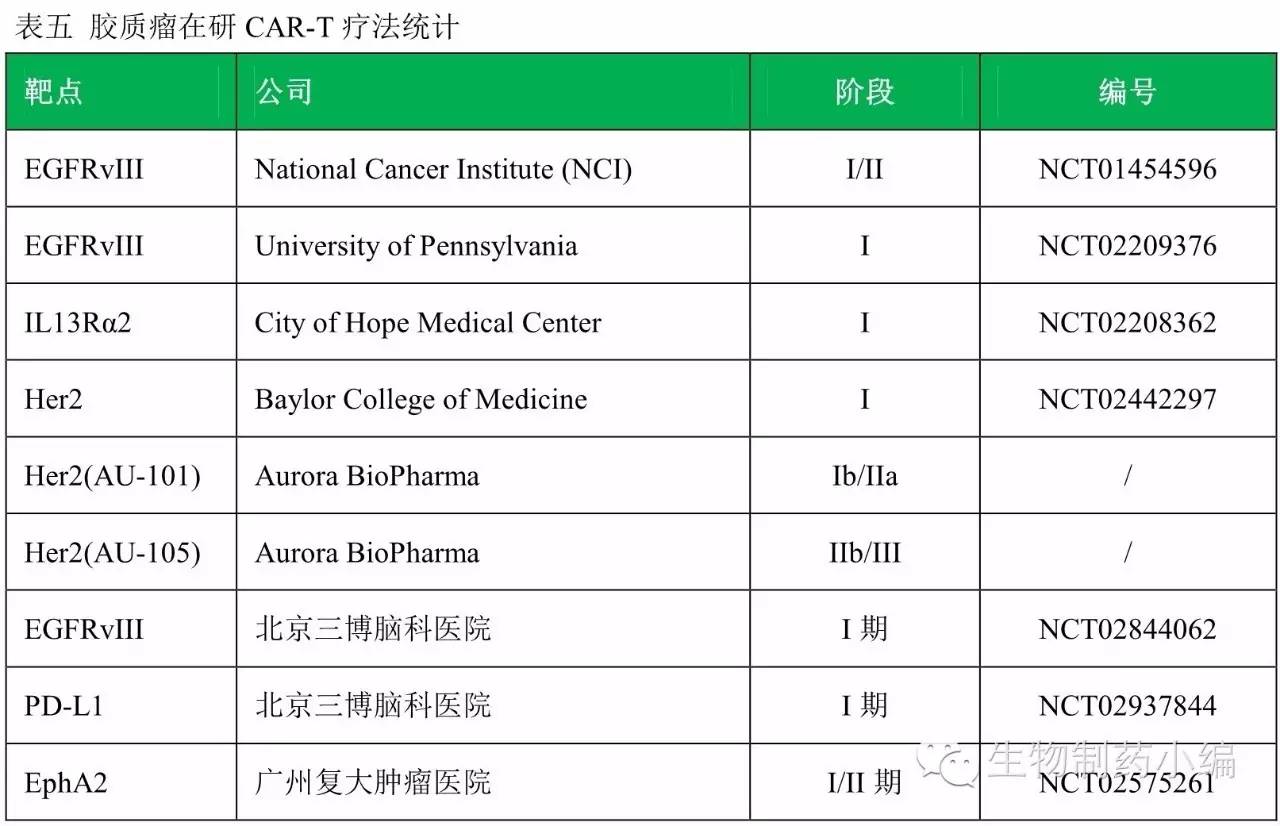
CAR-T疗法
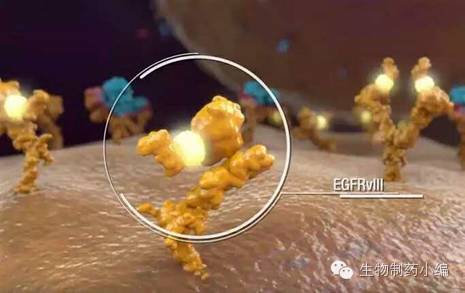
CAR-T细胞靶点抗原的选择决定着治疗的特异性、安全性和有效性。EGFRvIII是目前公认的肿瘤特异性抗原,EGFRvlll在低级别胶质瘤中表达率大约为30%,而在多形性胶质母细胞瘤(GBM)中可达24%~67%,但在正常脑组织中不表达。HER2及IL13Rα2同样在胶质瘤细胞表面表达上调,也是CAR-T细胞较理想的靶点。其他受关注的还包括EphA2、YKL-40、gpl00、Survivin、TRP-2、MAGE-1、AIM-2等。临床前试验显示靶向IL13Rα2的CART体现出对胶质瘤细胞极高的特异性,且存活率显著增加。最近一个针对Her2和IL13Rα2的双特异性CART细胞显示可以遏制胶质母细胞瘤的免疫逃逸。
免疫疗法目前对血液系统肿瘤、黑色素瘤等有了鼓舞人心的治疗作用,甚至出现了“治愈”的表现,这似乎已让人们看到了治疗肿瘤的曙光。然而胶质瘤则不然,相比之下,脑胶质瘤要复杂的多,因为血液系统肿瘤的微环境相对简单一些,是在体液当中,治疗反应相对比较明显一些。胶质瘤的微环境远远要比血液系统肿瘤复杂,而且具有高度异质性,所以免疫疗法依旧困难重重,任重道远。
南开大学:南开大学药物化学生物学国家重点实验室开发的抗脑胶质瘤新药ACT001,可突破血脑屏障,进入脑部,对肿瘤干细胞具有选择性杀灭效果。目前已在澳大利亚进入I期临床试验。
四川九章:四川九章就绿原酸围绕瘤谱探索、脑胶质瘤和给药途径探索及肺癌药效探索3个研究重点开展I期临床试验,结果显示,绿原酸的优势瘤谱为脑胶质瘤、肺癌、肝癌等恶性肿瘤。
海正药业:2016年7月引进美国Nascent公司Pritumumab项目。Pritumumab是一种天然人源抗体,由加州圣地亚哥生物技术公司Nascent Botech开发,该药物针对的是变异的与肿瘤相关的波形蛋白,该蛋白仅在多种肿瘤的细胞表面有表达,包括脑癌和黑色素瘤,Nascent已于日本开展了多个临床II期试验,结果显示Pritumumab的疗效显著好于标准疗法。目前FDA已授予Pritumumab孤儿药资格。
北海康成:2015年7月北海康成与Apogenix公司达成独家许可协议,北海康成将在中国内地、澳门和香港研发、生产和上市用于治疗脑胶质母细胞瘤(或其他适应症)靶向单抗药物CAN008。12月,北海康成与Apogenix 签署补充协议,获得了CAN008 在台湾的独家开发和上市的权利。9月26日,北海康成宣布CAN-008在台湾地区I/II期临床试验中,首位受试患者已经在台北市林口长庚纪念医院接受试验治疗。CAN008即为Apogenix公司的APG101,是一种抑制CD95配体的全人源融合蛋白,通过抑制CD95配体,CAN008具有双重功效,在恢复免疫功能的同时有效抑制肿瘤细胞生长。
参考资料
The Cancer Genome Atlas (TCGA) Research Network. Comprehensive genomic characterization defines human glioblastoma genes and core pathways. Nature. 2008 October 23; 455(7216): 1061–1068.
Hongxiang Wang etal. The Challenges and the Promise of Molecular Targeted Therapy in Malignant Gliomas. Neoplasia (2015) 17, 239–255
van Chekhonin and Olga Gurina. Trends in Malignant Glioma Monoclonal Antibody Therapy. Current Cancer Therapy Reviews, 2015, 11, 102-118
Neha Kamran et al. Recent advances and future of immunotherapy for glioblastoma. Expert Opin Biol Ther. 2016 October ; 16(10): 1245–1264.
Xuhao Zhang et al. Targeting immune checkpoints in malignant glioma. DOI: 10.18632/oncotarget.12702
http://www.cancerresearch.org/cancer-immunotherapy/impacting-all-cancers/brain-cancer
Jeffrey Raizer • Andrew Parsa Editors. Current Understanding and Treatment of Gliomas. Springer. 2015
Ryuya Yamanaka. Glioma Immunotherapeutic Approaches. Springer. 2012