
2型炎症通路描述的是Th2细胞( T helper 2,属于CD4+ T细胞)扮演关键角色的一种炎症通路,Th2可分泌IL-4、IL-5和IL-13并刺激2型免疫,表现为产生高浓度IgE和嗜酸性粒细胞。2型免疫是一种包含先天性免疫和适应性免疫并促使在黏膜表面形成免疫屏障清除病原体的特殊免疫反应。近些年的研究表明,2型炎症通路在过敏性疾病发生过程中起到重要作用。

▲2型炎症通路(FcεRI,高亲和力IgE受体;TARC,胸腺和激活调控趋化因子)
Th2细胞通过分泌2型细胞因子IL-4 、IL-5和IL-13在2型炎症通路中起到关键作用。IL-4可促进Th细胞分化为Th2细胞并增殖,Th2细胞进一步产生IL-4 、IL-5和IL-13。IL-5可促进骨髓中嗜酸性粒细胞分化,IL-4 、IL-5和IL-13可促使嗜酸性粒细胞转移到特定的组织,IL-4和IL-13还可B细胞的血清型转变进而产生IgE,IL-13还在黏液分泌、杯状细胞增生、平滑肌收缩、胶原产生等方面有重要作用。
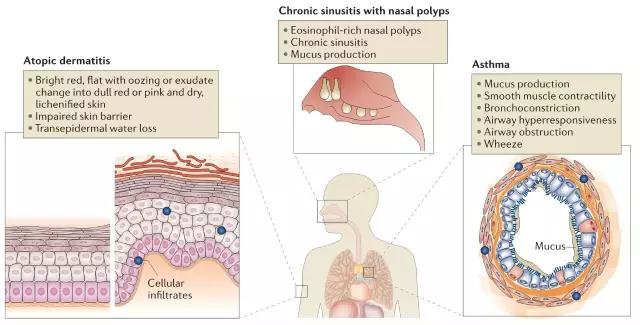
▲病理性2型免疫导致的过敏性疾病
2型炎症通路激活的典型标志是IgE、嗜酸性粒细胞及TARC升高,如果2型免疫反应激活过度就会产生严重过敏性疾病,在不同的组织具有不同的疾病表现形式,按照发生的部位不同可分为特应性皮炎、慢性鼻窦炎鼻息肉和哮喘等。
虽然一些过敏性疾病(如过敏性鼻炎)可以通过抗组胺药和特异性免疫药得到很好的治疗,然而对于一些更为严重的过敏性疾病如特应性皮炎及哮喘等缺乏特异性的治疗方法,非特异性免疫抑制仍然是主要的治疗方式。
全球大约超过2.35亿哮喘患者,美国大约有2500万,其中大约10-20%的患者不能由现有药物得到有效控制(哮喘恶化)且这部分患者的治疗费用占据所有哮喘治疗支出的80%。特应性皮炎影响10-20%儿童及3-10%成人共计约2500万美国患者,其中大约20%患者为中重度特应性皮炎,目前并没有有效的治疗药物。
口服/静脉注射广谱免疫抑制剂如类固醇、环孢菌素A、甲氨蝶呤、硫唑嘌吟及麦考酚酸莫酯等可有效缓解疾病症状。这些免疫抑制剂的活性主要来源于靶向炎症的下游调控因子(如转录因子):如类固醇结合糖皮质激素受体进而抑制驱动炎症的关键转录因子表达(如NF-kB);环孢菌素A是一种钙依赖磷酸酶抑制剂,可通过转录因子活化T细胞核因子(NFAT)阻止T细胞活化和增殖所需要的IL-2表达。
全身性用药广谱免疫抑制剂由于其多效性常常导致一系列副作用,如体液潴留、葡萄糖不耐受、高血压、肌无力、骨质疏松、下丘脑-垂体-肾上腺轴系抑制以及增加感染风险。虽然局部用药(如吸入剂、外用滴剂、皮喷剂、软膏等)可减少全身性用药的副作用,但是难以有效治疗严重过敏性疾病。如辉瑞去年12月份获批的非甾体PDE4抑制剂Eucrisa仅对轻度至中度特应性皮炎患者有效。
鉴于过敏性疾病特别是特应性皮炎和哮喘的高发病率以及广谱免疫抑制剂治疗的局限性(安全性及有效性),尤其是对于部分严重患者,存在未被满足的临床需求,需要更为安全有效的特异性治疗药物。
2型炎症通路的关键驱动因子
IL-4被认为是驱动Th2细胞反应的关键分化因子。IL-4可启动T细胞分化为Th2细胞,诱导产生2型免疫相关的细胞因子和趋化因子,如IL-5、IL-9、IL-13、TARC以及eotaxins。对于B细胞,IL-4可诱导其血清型转变产生IgE。
IL-4和IL-13是强效的2型免疫反应的调节子,根据结合受体的不同表现出对应的功能。IL-4和IL-13虽然仅有25%的氨基酸同源性,但是它们的受体复合物(I型受体和II型受体)有一个共同的组成部分IL‑4Rα,根据表达分布的细胞不同发挥不同的作用。IL-4可通过I型受体和II型受体发挥作用,而IL-13仅能通过II型受体发挥作用。IL-4与IL‑4Rα高亲和力结合且不依赖于γ-链or IL‑13Rα1,而IL‑4Rα可提高IL-13结合13Rα1的亲和力。
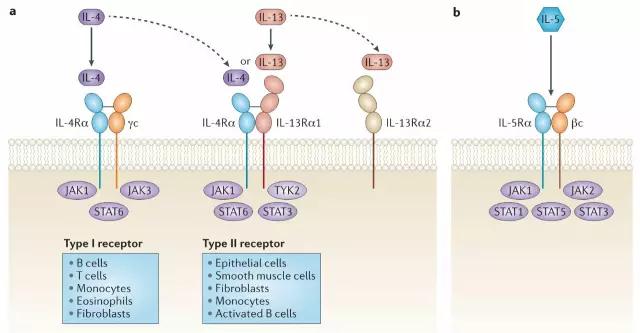
▲2型炎症通路的关键驱动因子
IL-5是一种强效的嗜酸性粒细胞因子,负责骨髓的生长、分化、存活以及迁移。IL‑5Rα在嗜酸性粒细胞上高表达,对于嗜酸性细胞清除血液及组织中的过敏原起到关键作用。
IL-4 、IL-5和IL-13在2型免疫中发挥多种重要作用,协同调控2型炎症通路的激活,呈现出2型炎症通路的典型特征:高浓度IgE和嗜酸性粒细胞。目前认为IL-4、IL-5和IL-13是2型炎症通路的关键驱动因子,是特异性治疗严重过敏性疾病(包括特意性皮炎、哮喘、特发性荨麻疹、慢性鼻窦炎鼻息肉以及食物过敏等)最具吸引力的一类靶点。
抗体药物研发情况
严重过敏性疾病的直接表现是呈现出高浓度的IgE和嗜酸性粒细胞,因此早期靶向2型炎症通路的抗体靶点是IgE,但是后来的研究发现靶向IgE对严重过敏性疾病的治疗并不具备普适性。随着对2型炎症通路的进一步了解,2型炎症通路的关键驱动因子IL-4 、IL-5和IL-13成为新一代治疗严重过敏性疾病抗体药物的热门研究靶点。
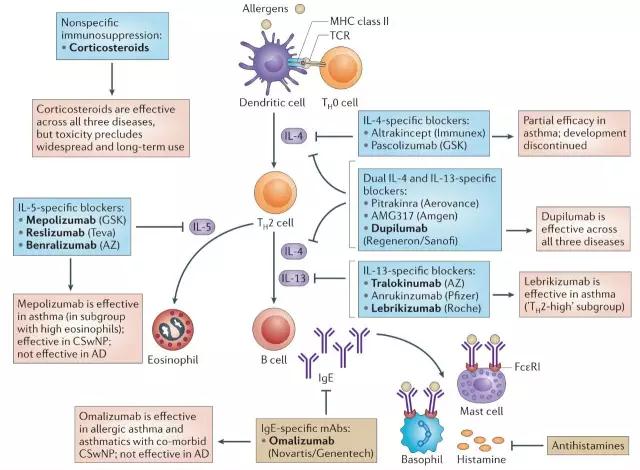
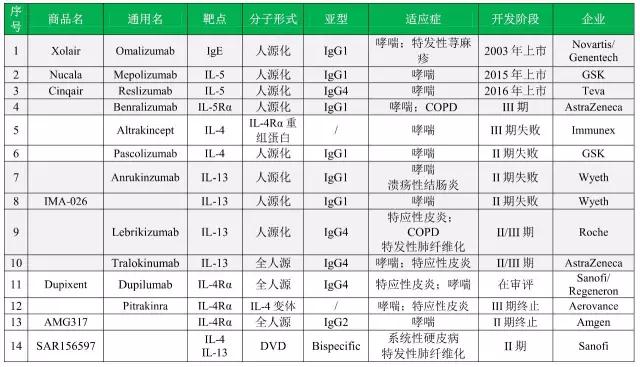
▲靶向2型炎症通路的主要抗体药物
IgE
IgE被认为在哮喘发生过程中起到重要作用已经超过30年历史。IgE可通过高亲和力IgE受体FcεRI结合肥大细胞、嗜碱性粒细胞以及DC细胞促使它们在过敏原暴露的情况下被激活。IgE与FcεRI结合后可引发肥大细胞、嗜碱性粒细胞释放促炎症因子并调节与暴露的过敏原之间的反应。
Omalizumab (Xolair; Novartis/Genentech)可特异性结合IgE阻断IgE与FcεRI之间的相互作用,继而阻止肥大细胞、嗜碱性粒细胞以及DC细胞激活。临床试验表明Omalizumab可减少50%的中重度哮喘恶化率而且几乎消除了儿童的季节性哮喘恶化。Omalizumab是第一个批准治疗哮喘的抗体(2003年),除此之外也已经批准治疗特发性荨麻疹(2014年),但是对特发性皮炎无效,因此也证明IgE并不是严重过敏性疾病的共同调节子。
IL-4
Altrakincept 是由Immunex开发的一种IL‑4Rα重组蛋白,通过喷雾给药竞争性结合IL-4,抑制体内IL-4与细胞表面IL‑4Rα的结合。Pascolizumab 是由GSK开发的一种IL-4抗体,阻止IL-4结合IL‑4Rα。这两种IL-4抑制剂虽然在早期研究(临床前、I期临床)中显示较好疗效,但是在大型的后期临床中并没有显示疗效,目前已经停止开发。
IL-5
IL-5是负责嗜酸性粒细胞生长、分化、招募、活化以及存活的主要细胞因子,IL-5抗体可特异性结合IL-5从而阻止IL-5与嗜酸性粒细胞表面的IL‑5Rα结合,减少嗜酸性粒细胞数量及活化。FDA已经批准两款IL-5抗体Mepolizumab(Nucala;GSK;2015年)和Reslizumab(Cinqair;Teva ;2016年)用于重度哮喘治疗,两者均可降低50%左右的哮喘恶化率。
AstraZeneca的IL-5Rα抗体Benralizumab 的作用机制相对已经上市的两款IL-5抗体而来显得更加简单粗暴,在结合嗜酸性粒细胞上的IL-5Rα后通过抗体的ADCC作用直接、快速清除骨髓、血液和组织中的嗜酸性粒细胞。Benralizumab已经完成两项关键性治疗重度哮喘的三期临床试验SIROCCO 和 CALIMA,达到主要临床终点,预计2017年下半年可获得FDA批准,鉴于该领域比较拥挤,业界并不是很看好其市场表现。
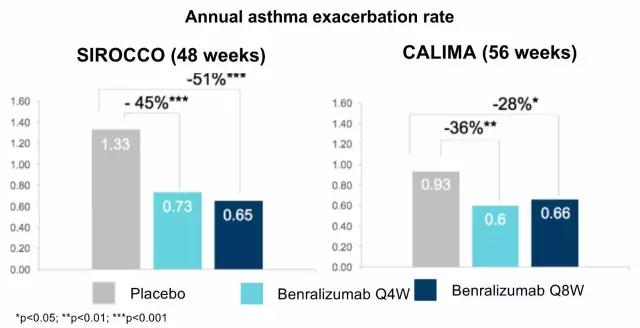
▲Benralizumab三期临床效果
IL-13
Wyeth曾经开发过两种IL-13人源化抗体Anrukinzumab和IMA‑026,它们结合IL-13的不同表位,虽然在临床前及早期临床中显示出较好疗效,但是疗效并没有在大型II期临床中重现,目前已经终止开发。
Tralokinumab是AstraZeneca开发的IL-13抗体,预计2017年下半年可获得治疗重度哮喘的III期临床结果,有望成为全球首个上市的IL-13抗体。同时AstraZeneca与Abbott共同开发基于生物标志物periostin和DPP4的伴随诊断方法。除此之外,Tralokinumab也已经完成治疗特异性皮炎的IIb期临床试验,并在2016年8月以1.15亿美元首付款的价格将特异性皮炎的全球权益独家转让给Leo制药。
Lebrikizumab是Roche开发的一种IL-13抗体药物。2016年2月末,罗氏披露了2项三期临床试验数据,结果一胜一负。在LavoltaI中,显示Lebrikizumab可以显著降低哮喘恶化率,而在LavoltaII中,则未能得到类似结果。根据在2017JP Morgan会议中披露的信息,Roche已经停止哮喘适应症的开发,而在COPD、特应性皮炎、特发性肺纤维化的多个II期临床正在进行中。
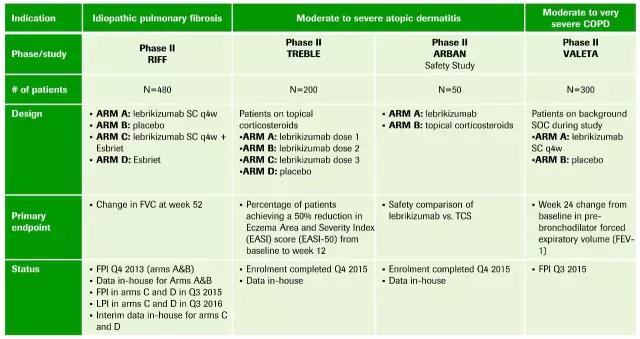
▲Lebrikizumab的研发进展
IL-4/IL-13
在前期的IL-4或IL-13单功能抑制剂开发遇到了诸多挫折(目前还没有产品上市)后,人们想到同时阻断IL-4和IL-13也许是一种可行的途径。同时阻断IL-4和IL-13有至少两种方法可以实现:一是IL‑4Rα抗体;二是IL-4和IL-13的双特异性抗体。
Regeneron通过Dual Trap技术制备的IL‑4Rα和IL‑13Rα融合蛋白在早期临床研究中取得了很好的效果(降低生物标志物),但由于缺乏资金而停止。
Pitrakinra 是Aerovance 开发的一种IL-4突变体,可高亲和力结合IL‑4Rα作为IL-4和IL-13的双重拮抗剂,可显著改善哮喘患者的FEV1(一秒用力呼气容积)。PEG修饰的Pitrakinra(Aeroderm)是第一个进行特应性皮炎临床试验的双重阻断剂,虽然显示一定的症状改善但疾病终点改善不具备统计意义。
AMG317是一种全人源IL‑4Rα抗体,抑制IL-4和IL-13的活性,但在治疗哮喘的II期临床遭遇失败而停止开发。
Dupilumab (Dupixent)是Sanofi/Regeneron开发的一种全人源IL-4Rα抗体,通过同时阻断IL-4和IL-13调节2型免疫。Dupilumab避开了较为拥挤的哮喘领域,首先开发缺乏有效治疗药物的特应性皮炎领域。
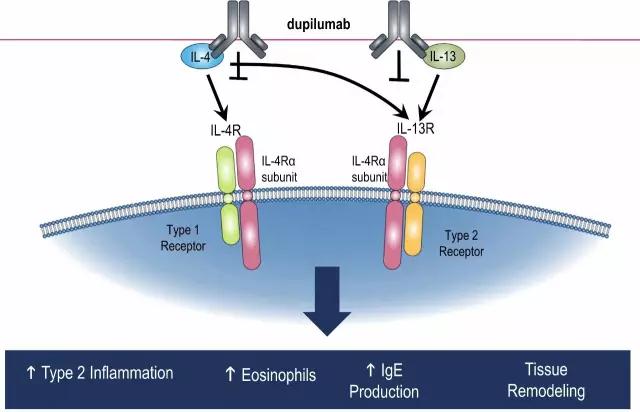
▲Dupilumab的作用机制
Dupilumab目前已经完成治疗中重度特应性皮炎的三项关键性III期临床研究(SOLO 1 、SOLO 2、CHRONOS),达到主要和次要终点。其中SOLO 1 和 SOLO 2评估Dupilumab的单药治疗效果而CHRONOS评估Dupilumab与外用糖皮质激素合用效果。
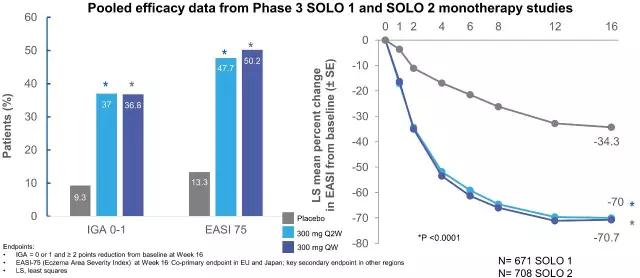
▲单用Dupilumab对特应性皮炎改善情况(IGA,研究者全局评估,IGA=0表示完全好转,IGA=1表示几乎完全好转;EASI,湿疹面积和严重指数,EASI75表示湿疹面积和严重指数降低75%)
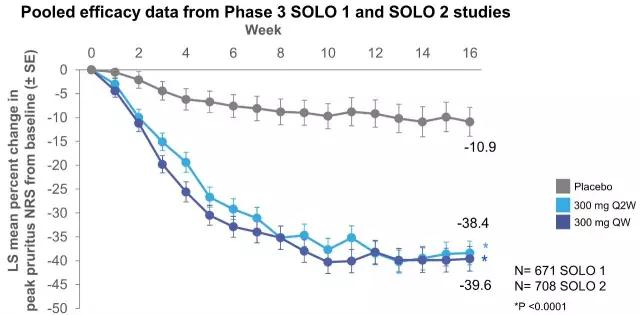
▲单用Dupilumab对特应性皮炎瘙痒改善情况
(NRS,瘙痒数值评定量表)
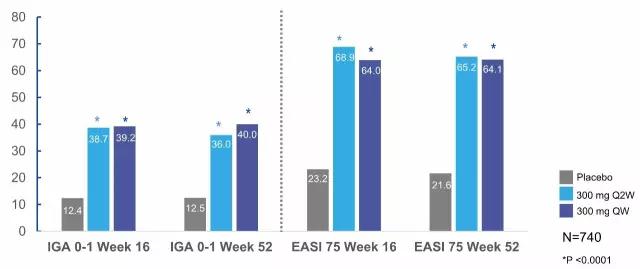
▲Dupilumab与外用糖皮质激素合用对特应性皮炎改善情况(拮抗IL-4可强化糖皮质激素的疗效,可一定程度解释联用可降低一半的糖皮质激素用量)
Dupilumab治疗中重度特应性皮炎在2014年12月获得FDA的突破性疗法认证并在2016年9月获得FDA优先审评,PDUFA日期为2017年3月29日,有望成为首个获批的IL-4Rα抗体和首个用于中重度特应性皮炎的生物制品,除此之外EMA在2016年12月接受其MAA申请。业界对Dupilumab的前景极为看好,成为重磅炸弹基本没有悬念。
同时Dupilumab正在开展哮喘、鼻息肉病、嗜酸性食管炎、食物过敏等适应症的多项临床试验。Dupilumab治疗哮喘的II期临床显示可显著改善FEV1并降低70%左右的哮喘恶化率。
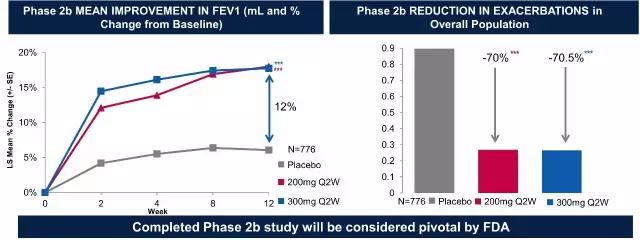
▲Dupilumab治疗哮喘的II期临床结果
SAR156597是Sanofi开发的一种靶向IL-4和IL-13的双可变结构域 Ig(DVD-Ig)双特异性抗体,用于治疗系统性硬皮病和特发性肺纤维化,目前处于II期临床。Roche也曾经通过“Knobs into Holes”技术平台做过基于Lebrikizumab改造的靶向IL-4和IL-13双特异性抗体,但是目前未见临床进展。
早期靶向2型炎症通路的抗体药物(含类似抗体药物作用机制的其他药物)研究进展不顺利,使业界一度怀疑2型炎症通路在过敏性疾病发生过程中的重要作用。然而根据已经发表的数据,早期的研究项目在许多方面存在一些问题,包括拮抗分子的性质、给药途径、生物利用度、研究人群等。
例1:Wyeth开发的两种结合IL-13不同表位的人源化抗体Anrukinzumab 和IMA‑026所采用的研究人群和试验设计高度相似,然而Anrukinzumab 和IMA‑026却表现出不同的疗效。这可能暗示表位结合的重要性,结合不同的表位使发挥的功能有较大的区别。Anrukinzumab与IL-13结合后可阻止IL-13结合IL-4Rα,然而IMA‑026与IL-13结合后阻止的却是IL-13结合IL-13Rα1和IL-13Rα2,最终导致下游信号通路的不同。
例2:对于Aerovance 开发的一种IL-4突变体Pitrakinra,喷雾给药并没有影响IgE和嗜酸性粒细胞的浓度,然而皮下给药可显著降低IgE含量,说明给药方式显著影响药物的疗效。
例3:早期的IL-4/IL-13双重抑制剂的失败可能源于其并不能足够持久有效的抑制IL-4和IL-13途径,比如AMG317清除IgE的能力有限且相对其他全人源抗体来说可被快速清除。
Dupilumab在多种适应症上的优异表现证明IL-4/IL-13信号通路可能与2型炎症通路中的严重过敏性疾病最为相关。然而遗憾的是,国内尚无靶向IL-4、IL-5和IL-13的抗体药物申报临床。
附表一 靶向2型炎症通路的主要抗体药物
参考文献
Namita A. Gandhi, Brandy L. Bennett, et al. Targeting key proximal drivers of type 2 inflammation in disease. Nature Reviews Drug Discovery,2016,15:35-50
Cezmi A Akdis. Therapiesfor allergic inflammation: refining strategies to induce tolerance. Nature Medicine,2012,18:736-749
Kasaian MT, Raible D, et al. IL-13 antibodies influence IL-13 clearance in humans by modulating scavenger activityof IL-13Rα2. J Immunol 2011; 187:561-569
Novartis、GSK、Teva、AstraZeneca、Roche、Amgen、 Sanofi、Regeneron等公司网站
Armstrong.哮喘适应症抗体药物研究报告.生物制药小编.
MT.以白介素IL为靶点的药物研究进展.生物制药小编.