
中国生物药申报美国IND之路系列:
KN035(PD-L1单域抗体)篇

前言
在华人抗体协会首届年会筹备panel discussion过程中,协会顾问傅道田博士曾经全面盘点过中国公司已经成功申报美国IND的所有中国创新药(试验阶段),这其中,仅有的7个生物药全部属于抗体类(如下表所示,其中Conbercept/康柏西普和健能隆的G-CSF-Fc均为Fc融合蛋白,也属于广义的抗体类蛋白药)。
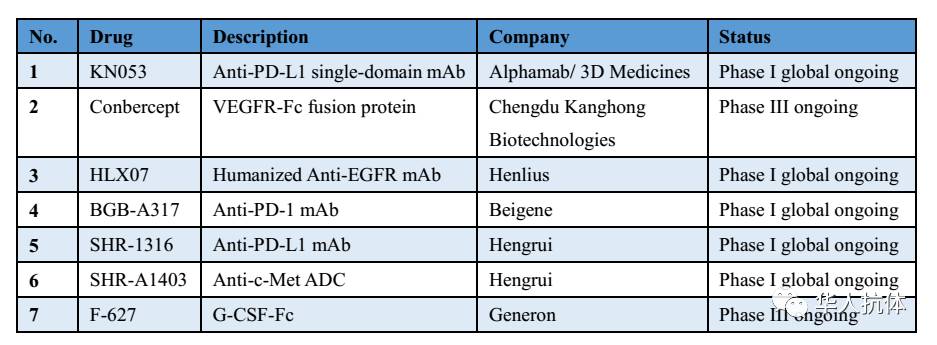
这7个生物药,由7家公司申报,即:康宁杰瑞(Alphamab)和思路迪(3D Medicines)联合申报了PD-L1单域抗体,成都康弘生物科技有限公司申报了著名的康柏西普,复宏汉霖申报了EGFR人源化单抗,百济神州申报了PD-1单抗(这也是中国第一个成功申报美国IND的生物药)。恒瑞作为中国药企的研发一哥,其在生物药的研发实力在中国也是名列前茅,有两个生物药已经成功申报美国IND。健能隆旗下的长效G-CSF-Fc(贝格司亭)已经于2016年第二季度进入美国临床III期阶段(NCT02872103),是国内罕见的能够在美国推进到III期的创新药。这7家公司都是中国生物制药公司在进军美国市场征程中的先行者,学习借鉴他们的成功经验,相信可以使后来的中国公司少走弯路。有鉴于此,华人抗体协会决定组织协会的3位有写作才华的志愿者写一个系列专题:“中国生物药申报美国IND之路”,对这7个药、申报的7家公司进行系列全景式报道(尤其侧重监管角度)。此文是第一篇,感谢思路迪CEO龚兆龙博士接受采访和对本文的贡献。
KN035是康宁杰瑞自主研发的抗PD-L1单域抗体。他们利用表达纯化的PD-L1抗原免疫新疆双峰驼后收集骆驼的外周血淋巴细胞,构建纳米抗体噬菌体免疫文库,再经过常规的噬菌体筛选、亲和力和特异性检测、人源化改造、与人IgG1的Fc段融合表达及功能的验证等,得到最终的抗体。
KN035的靶点为程序性坏死配体1(PD-L1),又称CD274、B7-H1等,是一种40KD大小的跨膜蛋白,在结肠癌、骨髓瘤、卵巢癌等多种人类癌细胞中高表达。多项研究表明PD-L1结合到表达于抗原特异性T细胞表面的受体PD-1上能够下调T细胞的活化和相应细胞因子的分泌,诱导T细胞凋亡,而PD-1下游信号通路的阻断可以激活机体对癌细胞的免疫反应,这启发了人们尝试阻断PD-1/PD-L1的相互作用或PD-1下游信号通路这一类新的癌症治疗策略。KN035即是特异性靶向PD-L1的抗体,意在通过与PD-L1的结合阻断PD-L1与T细胞上PD-1的相互作用,从而解除癌细胞对抗原特异性T细胞的免疫抑制,使T细胞发挥杀伤癌细胞的功能。
2016年4月28日,在通过江苏省食品药品监督管理局的形式审查和注册现场核查后,KN035于12月28日获得国家食品药品监督管理局(CFDA)临床批件; 2016年10月向美国食品药品监督管理局(FDA)递交KN035-IND,并在11月29日宣布通过审评。2017年5月,向日本PMDA提交IND申报。目前,KN035I期临床在中美同步开展,日本临床即将启动。
KN035的IND申请是国内首家在没有临床数据的情况下直接向FDA申报并获准在美国开展全球首次临床试验的项目。根据康宁杰瑞和思路迪的合作开发协议,康宁杰瑞负责临床样品和上市后药品生产,思路迪主导全球注册、临床开发和商业化。
康宁杰瑞与思路迪合作是整合双方优势,快速推进项目的战略决定。康宁杰瑞在生物药研发和生产有丰富经验,成功申报过多个生物药,并获得多个临床批件。思路迪的专注于肿瘤的精准医疗公司,致力于整合基因检测、数据分析和挖掘,以及精准药物开发,以期实现肿瘤的早期筛查、患者的人群分层、合理的用药建议、以及精准药物研发等。针对KN035的临床试验,思路迪基于对患者进行的肿瘤标志物表达情况的筛查等工作,设计临床试验方案,确定可以入组的患者,以提高临床试验的针对性和准确性,从而降低临床开发风险,提高药物开发的成功率。
同时,思路迪在国际注册方面有一定优势。首席执行官龚兆龙博士,拥有10年的FDA新药审评工作经验,并曾在百济神州等多家新药研发企业担任高管,熟悉药物开发和审评的相关国际法规,这无疑会加速KN035的IND申报。
申报IND需要的材料主要包括3个方面:药学(CMC)资料、药理毒理数据,和临床试验方案。KN035的CMC由康宁杰瑞自主完成。其中,生产方面,据康宁杰瑞介绍,该公司具有符合中国新版GMP标准和欧美标准的中试生产车间,具有3000L的重组蛋白和抗体原液中试生产能力。BioCon会议公布的数据显示,KN035的生产采用的是CHO细胞株,表达量大于7g/L;下游纯化采用非protein A的纯化工艺。质控方面,KN035的纯度可达99%以上,且可以在控制蛋白聚体含量的前提下将抗体浓缩到200g/L的高浓度。另外,康宁杰瑞已按照ICH、FDA、EMA和中国新版GMP标准建立了药品的质量体系。毒理实验由CFDA中国药品生物制品检定所下属的国家药物安全评价检测中心完成。临床试验方案由思路迪负责完成。思路迪在临床试验方案的制定上的优势,源于其精准医疗的优势。他们根据PD-L1表达水平和其他指标将病人进行分层,确定可以入组试验的病人,在此基础上设计和开展试验。FDA对临床试验的监管是一个动态的风险控制的过程。在设计上降低试验风险和提高试验成功率,自然有助于方案的通过。
而在实际的申报过程中,龚兆龙博士的国际注册经验、在FDA的人脉等这些优势自然不可或缺。他说,所谓的经验和人脉,其作用就是帮助我们更好地熟悉和理解相关的法规和流程,在申报过程中更好地与监管部门进行及时和有效的沟通,这对申报效率的提高起到了极大的作用。
KN035在美国的临床试验外包给了著名临床CRO公司INC Research,在2个机构开展,目前I期临床进展顺利给药方式为皮下注射。据龚兆龙博士透露,从目前的临床结果来看,当前所使用的剂量安全性很好。KN035在中国的临床试验外包给了我国领先的临床CRO公司泰格医药,目前中国的I期临床试验已经在解放军307医院开展。
根据KN035 整体临床开发规划,美国的临床实验只是KN035全球同步临床试验的一个开端。针对KN035所设计的I期临床是是美国、中国和日本的同步临床试验。首次人体试验先从美国开始,没有安全性问题,中国在提升2个剂量后加入;日本在提升另2个剂量后加入。国际同步I期临床研究,可以尽可能减少参与临床试验而不明显获益的病人数量,符合伦理要求,同时不同国家数据可以互相参照,降低临床风险,提高临床研究效率。在完成I期临床后,将迅速启动国际多中心临床试验(MRCT),争取尽快在国内外上市。
龚兆龙博士说,KN035成功申报首先是康宁杰瑞和思路迪双方精诚合作共同努力的结果。合作伙伴对于项目的成败和效率非常关键。康宁杰瑞和思路迪的合作,将康宁杰瑞的前期研发、CMC等优势与思路迪的注册经验和临床开发的优势联合起来,实现了资源互补,极大地提高了药物开发的效率。双方在去年2月份签署合作协议,11月份即成功使KN035项目在没有临床数据的情况下成功申报在美国开展全球首次临床试验,效率非常高。
其次项目的选择非常重要,在激烈的国际竞争中项目的差异化优势非常关键。KN035是全新分子的单域抗体,是目前全球唯一可以皮下注射的PD1/PDL1抗体,便于病人用药,有助于改善病人生活品质,降低用药成本,在全球市场有很强竞争力,有望在全球市场占有一席之地。
至于此次申报给大家的启发,龚博士认为主要是要有一个提前布局的意识。随着国家药监总局国际多中心临床试验和进口药品注册管理等新政策的落地,中国在加入ICH后融入新药的全球同步临床研究是大势所趋。而早在康宁杰瑞和思路迪的合作之初,双方就确定了针对KN035的全球开发策略,并提前做好了相应准备。提前布局的意识和行动,能帮助企业在药物全球研发竞争中不落下风,这值得国内其他药企学习和借鉴。
与KN035靶点相同,即针对PD-L1的抗体,国内外均有在研项目。在国内,目前除了康宁杰瑞之外,还没有企业拥有已获批临床的PD-L1抗体,正在申报临床的有3家:
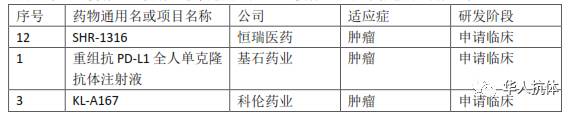
恒瑞的SHR-1316已于今年初通过FDA的IND审评,获准在美国开展临床试验;而在国内,SHR-1316临床试验申请正在审评中,暂未获批。另外,基石药业和科伦药业的抗PD-L1抗体项目也被CFDA受理并在审评中。而KN035已经在解放军307医院开始了一期临床试验并早在3月31日就完成第一次给药,在时间上有明显的优势。
而在国外,临床开发的竞争就激烈很多。截止目前至少已进入临床开发阶段的抗PD-L1抗体药物列表如下(以Clinicaltrials.gov网站上公布的信息为准):
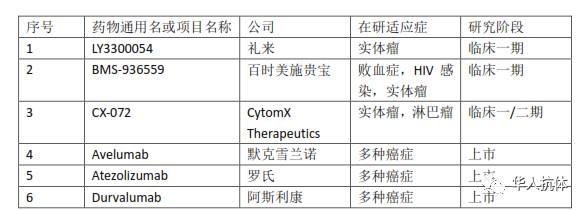
礼来的LY3300054和百时美施贵宝的BMS-936559目前处于临床一期阶段。LY3300054正在进行的临床试验有2个,均为国际多中心试验。其中,NCT02791334试验是单药或与其他药物联合使用,检测LY3300054的安全性和机体耐受性;而在NCT03099109中,LY3300054被用来与礼来研发的抗Tim-3的单抗LY3321367联合使用,测试LY3321367的安全性。BMS-936559的临床试验和适应症则较多,包括正在招募患者的NCT02576457试验(针对严重败血症患者)、已经完成的NCT02028403试验(针对接受过抗逆转录病毒组合治疗、体内病毒负载低于检测水平的HIV感染患者)等,不局限于癌症这一适应症类别。CytomX Therapeutics的CX-072处在临床一/二期(NCT03013491),单药或与ipilimumab、vemurafenib联合使用,检测CX-072的安全性、药代动力学情况和抗肿瘤效果。而其余3个抗体药物(Avelumab、Atezolizumab、Durvalumab)已获批上市。其中最早获批的是由罗氏开发的Atezolizumab(2016年5月18日),目前获批的适应症为非小细胞肺癌和尿路上皮癌,膀胱癌、转移性乳腺癌等适应症的三期临床研究正在进行中。由默克雪兰诺开发的Avelumab目前获批的适应症为转移性默克尔细胞癌和尿路上皮癌,而针对卵巢癌、肾细胞癌等适应症的几项临床实验也已进入三期。最近获批的是由阿斯利康子公司MedImmune研发的Durvalumab(2017年5月1日),目前获批的适应症为尿路上皮癌,其他多项适应症正在研究中。
可见,针对这一靶点的临床试验竞争非常激烈。KN035若想要在这样的竞争中占有一席之地,在将来的全球市场上分一杯羹,仍需漫长的努力。
KN035作为国内第一个申报美国FDA和中国CFDA临床成功的PD-L1抗体项目、国内第一个在没有临床数据的情况下申报美国IND成功在美国开展全球首次临床试验的抗体项目,它到目前为止的成功值得称赞。同时,康宁杰瑞对该项目扎实的前期研发、与思路迪之间成功的商业合作,以及两家公司对药物全球化开发的理解和把握,值得大家学习和参考。KN035全球同步临床试验的顺利开展,得益于CFDA对创新药的加快审评政策。CFDA一系列鼓励创新的新政策的推出,有望进一步缩短新药审评审批时间,将极大推动国内医药企业的国际化进程,帮助国内优秀品种进入国际市场。未来肿瘤将成为慢性病,作为慢病管理,KN035在给药,储存,携带等方面有临床价值的差异化优势将有助于该品在竞争激烈的PD1/PDL1国际市场上占一席之地。
当然,祝贺归祝贺,脚下的路还是要踏实去走。KN035距离成功上市、成功造福广大患者还有很长的路要走,有很多可能的问题有待发现和解决,有日趋激烈的竞争需要面对。在一个好的开头的基础上,我们需满怀信心,踏实细致,兼具灵活的策略和扎实的工作,相信成功终会到来。