
背景信息
CD47也被称为整合素相关蛋白(integrin associated protein,IAP)。CD47广泛的表达于细胞的表面,可与信号调节蛋白α (Signal regulatory protein α, SIRP α)、血小板反应蛋白(thrombospondin-1, TSP1)以及整合素(integrins)相互作用,介导细胞凋亡、增殖、免疫等一系列反应[1,2]。
CD47为5次跨膜蛋白,分子量在50kDa左右,属于免疫球蛋白超家族,胞外N端为IgV结构域。CD47在19世纪80年代首次被确认为人类卵巢癌的肿瘤抗原,继而CD47被发现在多种人类肿瘤类型中表达,包括急性骨髓白血病(AML)、慢性骨髓白血病(CML)、急性淋巴细胞白血病(ALL)、非霍金性淋巴瘤(NHL)、多发性骨髓瘤(MM)、膀胱癌和其他实体瘤。
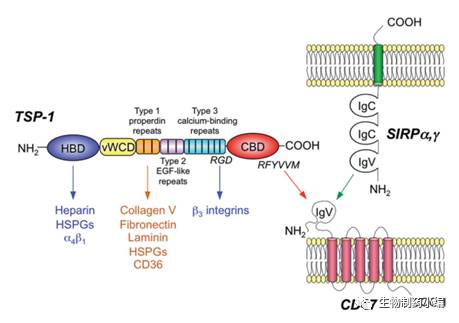
图1. CD47结构及受体图示
CD47是"自我"信号,代表"别吃我"。人体需要20-30万亿的红细胞,以此保持氧气有效的运输到全身各处。红细胞的生命周期较短仅有120天,每小时有100亿的红细胞生成,也有无数衰老的红细胞被巨噬细胞吞噬清除。然而巨噬细胞是如何区分年轻和衰老的红细胞,只进攻衰老红细胞的机理却不为人知。直到2000年,Oldenborg等人证实CD47是细胞表面一个重要的"self"标记,是调节巨噬细胞吞噬作用的一个重要信号。CD47可以与巨噬细胞表面SIRPα结合,磷酸化其ITIM,随后招募SHP-1蛋白,产生一系列的级联反应抑制巨噬细胞的吞噬作用。年轻的红细胞表达较高的CD47向巨噬细胞释放"自己人,别吃我"的信号,而衰老的红细胞CD47下调,最终被巨噬细胞所清除[3]。
狡猾的肿瘤细胞高表达CD47躲避吞噬肿瘤细胞有一系列躲避人体免疫系统追杀的方案,包括分泌免疫抑制因子、下调MHC I表达,以及上调PD-L1抑制CD8+T细胞活性。聪明的肿瘤细胞当然不会放过CD47这个完美的掩体。不同的研究表明,几乎所有的肿瘤细胞和组织都高表达CD47,是对应正常细胞和组织的3倍。通过CD47这个"self"信号,肿瘤细胞有效的躲避了巨噬细胞的吞噬作用[4-6]。
CD47肿瘤靶点免疫治疗可行性
1.靶向性机理
由于CD47广泛表达于多种肿瘤细胞,肿瘤细胞可通过CD47-SIRPa信号通路逃逸巨噬细胞的免疫监视,因此通过CD47抗体或受体阻断CD47与SIRPa的结合可以激活巨噬细胞对肿瘤的吞噬作用,以及DC细胞的递呈抗原作用,同时可以与其他肿瘤杀伤途径联合治疗,如免疫治疗、小分子靶向药物、化疗、放疗等。
肿瘤细胞上调CD47的表达,以此欺骗巨噬细胞。那么通过CD47抗体block这个"别吃我"的信号,使巨噬细胞发挥吞噬作用,是一个容易理解的事情,如图2。关于这个机理Forty Seven的创始人斯坦福大学的Weissman博士做了一系列的工作论证。Liu等人研究表明,CD47抗体治疗是通过DC细胞和CD8+T发挥肿瘤杀伤效应的。DC细胞通过CD47抗体和亲吞噬分子协同作用,吞噬肿瘤细胞,并提呈肿瘤相关抗原给CD8+T,进而发挥CD8+T对肿瘤的特异性杀伤作用[7],如图3。
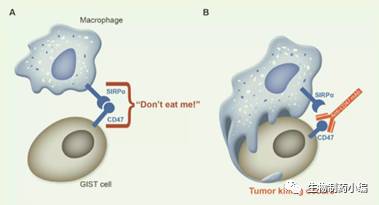
图2.阻断CD47使巨噬细胞发挥吞噬作用
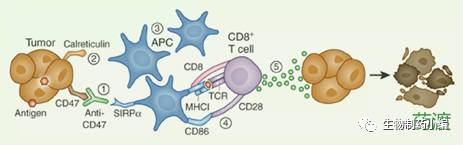
图3.阻断CD47使DC细胞吞噬并呈递肿瘤抗原,进而发挥CD8+肿瘤杀伤
2.安全性及有效性
巨噬细胞发挥吞噬作用,不仅需要block CD47的"自己人,别吃我"信号,也需要钙网织蛋白(calreticulin,CRT)等“吃我”信号的协同作用。通常情况下肿瘤细胞高表达CRT而正常细胞并不表达CRT等"吃我"信号,所以尽管CD47也广泛在人的大脑皮层以及小脑等健康组织中,CD47抗体治疗在正常组织中被认为是沉默的。然而,观察Phase 1的临床数据,接受放疗和化疗后的患者会上调"吃我"信号。CD47抗体治疗后,CD47+红细胞枯竭,造成短暂性的贫血是其主要的不良反应。虽然该不良反应在临床上比较好控制,但是CD47抗体治疗是否真的对正常组织没有伤害,是目前最为重要的一个问题[8]。
或许CD47抗体或其配体重组蛋白(SIRPa)是继PD1/PD-L1抗体之后,下一代肿瘤免疫抑制剂产品重磅药物。
两者确实有相似之处,CD47与PD-L1都受转录因子myc的调控[9];CD47与PD1/PD-L1都是负负得正的作用机制。从某些方面来讲,CD47抗体比PD1/PD-L1抗体更加具有吸引力。首先是CD47具有更为广泛的表达,以及在所有肿瘤细胞中几乎都高表达,代表着其具有更为广谱的效应。第二,Liu等人工作表明,CD47抗体可以介导CD8+T对肿瘤的特异性杀伤作用[7]。PD-1、CTLA-4等肿瘤免疫抑制剂之所以仅对一小部分发挥作用,也许一个重要的原因就是PD-1/CTLA-4抗体,无法形成肿瘤特异性的杀伤T细胞[10]。
斯坦福大学医学院的研究人员开发的靶向CD47的抗体,可以安全、有效地治疗五种类型的儿科脑瘤。癌细胞正是以CD47与巨噬细胞上的SIRPα相互作用,发出“不要吃我”的信号。这一名为Hu5F9-G4的抗CD47抗体则可阻断上述相互作用,促使巨噬细胞吞噬脑癌细胞,同时不伤害健康的脑细胞。“Hu5F9-G4对正常人脑细胞没有毒性,但是在体内却有非常活跃的肿瘤杀伤效应,”他说:“鉴于这一新研究和抗CD47抗体成人患者临床研究的令人鼓舞的结果,这些抗体有望在一至两年进入儿科脑瘤的临床试验。当CD47被Hu5F9-G4阻断后,钙网蛋白便终于有了“出头之日”,诱导巨噬细胞前来将癌细胞吞噬。
Trillium Therapeutics Inc及国内宜明昂科开发的SIRPa-Fc在动物实验阶段都取得了显著的抑制肿瘤生长效果,如图4、5。
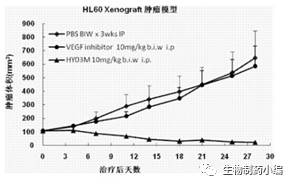
图4.宜明昂科SIRPa-Fc融合蛋白体内肿瘤抑制作用
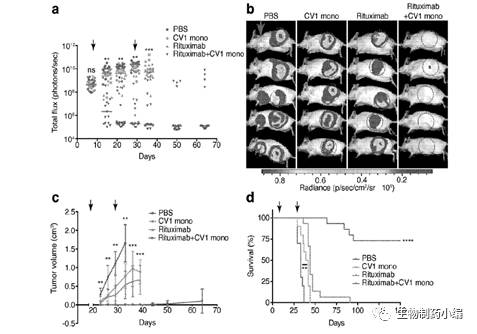
图5.Trillium TherapeuticsInc SIRPa-Fc融合蛋白体内肿瘤抑制作用
除了肿瘤的治疗,日前Nicholas Leeper等人的研究表明,CD47抗体在一些动脉粥样硬化小鼠模型中,具有积极的效果,表明其应用于心血管领域的潜力[11],如果这种成功也在人体研究中重现的话,那么这种药物可能能够被用来治疗作为世界头号杀手的心血管疾病,而且是针对这种疾病的直接病因---动脉粥样硬化斑块---而不是高胆固醇或高血压等风险因子来实现的。另外,US2016/0333093A1专利中讲述CD47作为SCLC(小细胞肺癌)靶点的治疗可行性,包括肿瘤细胞系及病人肿瘤细胞移植NSG小鼠(PDX)对CD47 阻断的肿瘤抑制效果,对SCLC肿瘤细胞表面候选靶分子考察,CD47与CD56联合阻断效果等。CD47抗体与其他抗体的联合治疗方案也在积极的研究中,相信不久的将来我们就能看到CD47联合CD40/PD-1/CTLA-4等抗体的治疗方案进入临床试验。
市场信息:CD47靶点目前的研发格局
1. 国外研发状况:CD47项目(包括抗体及融合蛋白)都处在早期,产品竞争也没有那么激烈。根据BioCentury数据显示,全球共有3个CD47抗体项目处于Phase 1阶段、1个处于IND阶段,以及4个临床前阶段。(图6)
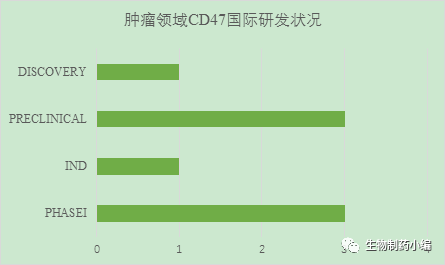
图6. 肿瘤抗体领域CD47抗体研发情况一览
目前处于Phase 1的三个药物分别为FortySeven的Hu5F9-G4、Celgene的CC-90002(来自Inhibrx,原代码为INBRX-103)以及Trillium的TTI-621。Forty Seven于2017年10月24日完成了B轮7500万美元融资,相信其临床结果得到了投资者们的青睐,该公司的首席执行官Mark McCamish表示:“ Forty Seven在多个临床试验中继续取得巨大进步。融资使我们能够严格探索不同肿瘤对Hu5F9-G4单药治疗和联合治疗的临床反应,并确定如何尽快将这种新治疗方案带给患者,其他的1期临床数据会在2017-2018年陆续揭晓。”
值得一提的是,Trillium Therapeutics的CD47抗体项目为SIRPαFc融合蛋白,与Hu5F9-G4具相类似的CD47亲和力(nM级别)。而SIRPαFc具有两大优势: 首先是其分子量更小约90kDa,相对于抗体分子的150kDa具有更好的穿透性和组织分布性;其次SIRPαFc对于红细胞的亲和力要远远低于Hu5F9-G4,表明其可能具有更好的安全性。在CD47抗体的肿瘤治疗领域,TrilliumTherapeutics的SIRPαFc融合蛋白也许会有差异化的优势。
另外,进展较快的还有Novimmune的NI-1701,计划于2017年的上半年开展Phase1临床试验。NI-1701是CD19与CD47的双特异性抗体,通过CD19靶向肿瘤细胞,并阻断CD47的"别吃我"信号,同时利用Fc片段招募巨噬和NK等细胞发挥肿瘤杀伤作用。CD19增加了NI-1701的特异性,保证了其安全性,但是相对来说也影响了其作用的广谱性。NI-1701很难应用至B淋巴细胞肿瘤以外的肿瘤治疗中。
2. 国内研发状况:资本的大量涌入、CFDA的加速改革,目前中国已然成为药物研发的新兴热土。虽然在CDE查询到还没有进入临床的CD47抗体或受体重组蛋白项目,但是国内与国际的快速接轨,使得中国的诸多企业能够在第一时间内快速跟进,相信已有不少公司已经加入到以CD47为靶点的肿瘤免疫治疗的研发方向。目前推进比较快的当属宜明昂科的重组融合蛋白IMM01项目,预计会在2018年拿到临床批件。(图7)同时从其研发产品线可看出,宜明昂科对CD47的市场预期有着极大的信心。

图7. 宜明昂科Pipeline
作者介绍
Tim,毕业于厦门大学传染病国家诊断试剂与疫苗工程技术研究中心,现致力于肿瘤靶向治疗。
参考文献
CD47 update: a multifaceted actor in thetumor microenvironment of potential therapeutic interest.
The CD47-SIRPα pathway in cancer immune evasion and potential therapeutic implications.
Role of CD47 as a Marker of Self on Red Blood Cells.
CD47 Is Upregulated on Circulating Hematopoietic Stem Cells and Leukemia Cells to Avoid Phagocytosis.
TheCD47-signal regulatory protein alpha(SIRPa) interaction is a therapeutic target for human solid tumors.
Anti-CD47 Antibody Synergizes with Rituximab to Promote Phagocytosis and Eradicate Non-Hodgkin Lymphoma.
CD47 Blockade Triggers T Cell–Mediated Destruction of Immunogenic Tumors.
Molecular Pathways: Activating T Cells after Cancer Cell Phagocytosis from Blockade ofCD47 “Don'tEat Me” Signals.
MYC regulates the antitumor immune responsethrough CD47 and PD-L1.
On being less tolerant: enhanced cancer immunesurveillance enabled by targeting checkpoints and agonists of T cell activation.
CD47-blocking antibodies restore phagocytosis and prevent atherosclerosis.