
许多生物药物都是糖基化蛋白质,而单克隆抗体 (mAb)又是其中最大的一类。适当的糖基化对于糖蛋白的安全性、生物活性、溶解性、稳定性和药代动力 学特性而言至关重要。事实上,大量研究表明,特定的糖基化类型会对mAb的效应因子功能(更强的Fcγ RIIIa结合能力和无岩藻糖基化或半乳糖基化变体 ADCC)、半衰期(加速高甘露糖糖型的清除)、抗炎特性(由Neu5Ac唾液酸化调控)和免疫原性(增加 Neu5Gc唾液酸化和半乳糖-α1,3-半乳糖基序)产生重要影响。因此,治疗性mAb的糖基化谱图被视为原研药和生物类似药的一项关键品质属性。通过高灵敏度分析对其进行早期表征有助于我们在随后的开发阶段做出明智决策。
治疗性蛋白质通常在不同的表达系统中产生,其糖基化机制通过顺序及竞争步骤发挥作用,因此会造成糖基化的微观异质性(特定位点的糖基性质)和宏观异质性(位点的数量和位置)。例如,采用SP2/0或NS0细胞可制得一部分二等分聚糖,而采用CHO细胞则不会如此。
这种微观与宏观异质性的结合带来了极具挑战性的分析难题,必须采用不同分析水平(游离寡糖、肽、完整蛋白质及亚基)的正交分析技术才能解决(图1)。通过游离寡糖分析可获得糖基化谱图,而肽图分析可用于确定糖基在蛋白质上的精确位置。在本应用纪要中, 我们使用质谱表征了阿达木单抗(一种商品名为Humira®的TNFα结合剂,用于治疗多种炎症性自身免疫疾病)和西妥昔单抗(一种针对表皮生长因子受体(EGFR)的嵌合人-小 鼠IgG1 mAb,商品名为Erbitux®,用于治疗结肠直肠癌和头颈部鳞状细胞癌)的N-糖基化。前者具有大多 数治疗性单克隆抗体都有的典型Fc(CH2功能区)糖基 化结构,而后者的Fab亚基上也有大型的复杂糖基, 与患者高发的超敏反应有关。
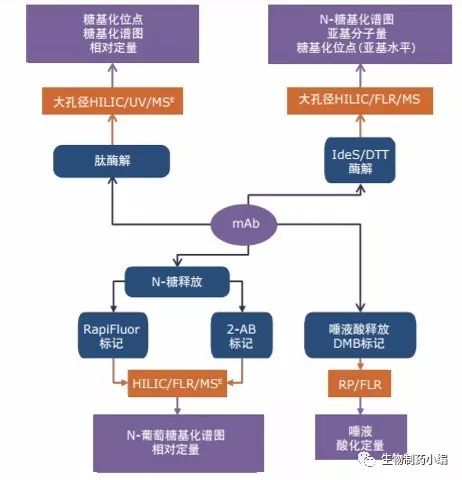
图1:表征单克隆抗体糖基化的分析流程。
N-糖分析
研究糖蛋白N-糖基化的常用方法之一是分析由特定内切糖苷酶释放的N-糖。我们开发了一种使用重组 蛋白质Rapid PNGase F(纽英伦生物技术公司)的优 化方案,用以快速定量N-去糖基化蛋白。采用西妥昔单抗来评估去糖基化程度,因为连接到这种单克隆 抗体F(ab’)2部分的糖基极难裂解。典型方案只能实 现部分去糖基化,而优化方案(其包括在高温条件下使用表面活性剂进行的预变性步骤)能够实现完全去糖基化(图2)。该方案不仅能无偏差地研究游离寡糖, 还能提供完整蛋白质水平的mAb分子量。本应用纪要末尾部分将详细介绍完整蛋白质水平的分析。
接下来,为游离N-糖标记2-AB荧光标记,然后进行检测和半定量分析。释放、标记和预纯化步骤在一天之内即可完成,然后可过夜执行LC-MS分析。不过, 我们最近换用了高性能的RapiFluor-MS试剂盒(沃特世),这款试剂盒的替代标记方法能够更加快速地完 成样品制备步骤,荧光和MS灵敏度也更高,而且最少仅需15 µg mAb。在任何情况下均可使用96孔固相 萃取板进行预纯化,然后通过与荧光检测器和 ESI-Q-TOF质谱仪联用的HILIC模式液相色谱进行分析。鉴定方法基于使用葡聚糖校准曲线标准品进行的校准(以葡萄糖单元(GU)为单位;图3)以及MS确证。 此外,使用MSE模式记录碎片离子数据,在这种模式 下,仪器每秒交替采集低能量和高能量谱图,以消除可能存在的不确定性。鉴定和半定量分析均通过 UNIFI 1.8(沃特世)以半自动方式完成。
表1:RapiFluor标记的阿达木单抗和西妥昔单抗N-糖的HILIC分析条件。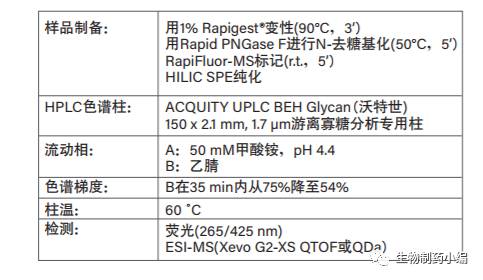
由于游离寡糖鉴定主要依赖保留时间完成,因此避免进样序列发生保留漂移至关重要。在本例中,我们在一系列共8个样品进样之前和之后执行两组葡聚糖校准曲线标准品进样,以确认未发生漂移。实测保留时间和峰面积的偏差极小(RS DRT = 0.08%,RSD% 峰面积 = 0.78%;n = 13)。
为了进一步展示该方法制备样品和进样的高重现性, 我们使用糖基化谱图已知的IgG标准品(沃特世)单独 制备了三个样品,并在整个进样序列中进样(图4)。 同样地,保留时间漂移极小(RSD RT = 0.08%;n = 12)。更有趣的是,每种游离寡糖的相对含量也具有 高重现性(RSD% 峰面积 = 2.45%;n = 12),丰度最高的物质尤其如此(%含量 > 1%,RSD%峰面积 = 0.89%; n = 5)。
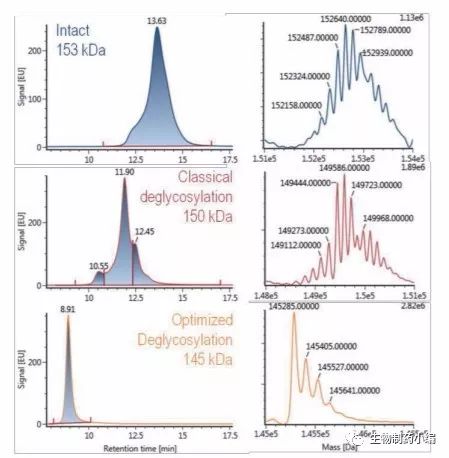
图2:西妥昔单抗的HILIC色谱图(左图;固有荧光检测) - 完整蛋白质(上图)、典型去糖基化(中图)以及经优化方案处理之后再去糖基化(下图),及其对应的去卷积质谱图(右图)。
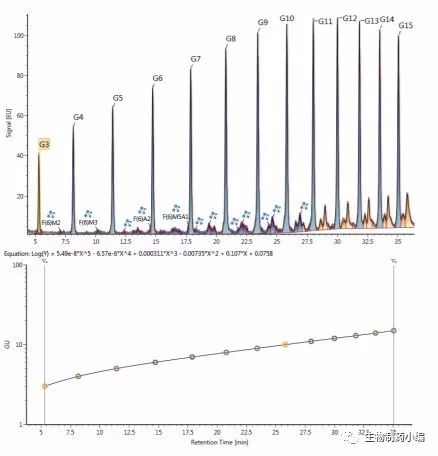
图3:上图:对RapiFluor-MS标记的葡聚糖校准曲线标准品进行 HILIC分离所得的叠加荧光色谱图(4次分段进样;平均RSDRT = 0.08%)。下图:GU校准曲线。
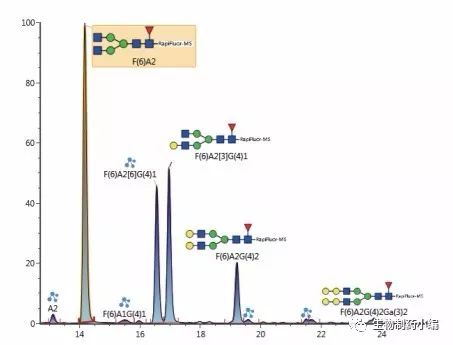
图4:使用Rapid PNGase F释放标准品IgG的N-糖(沃特世)之后用 RapiFluor-MS标记,然后进行HILIC分离所得的叠加荧光色谱图 (在位置1、4和8分三次进样单独制备的样品)。
阿达木单抗具有典型的糖基化结构,主要包括岩藻糖基化的双天线糖基,带有可变的半乳糖基化结构(G0F、 G1F、G2F),以及几种高甘露糖物质(Man5、Man6) (图5)。由两名分析人员分两天单独制备样品进行分析所得的结果非常接近(RSD%峰面积 = 0.8%;n = 7) (图6)。
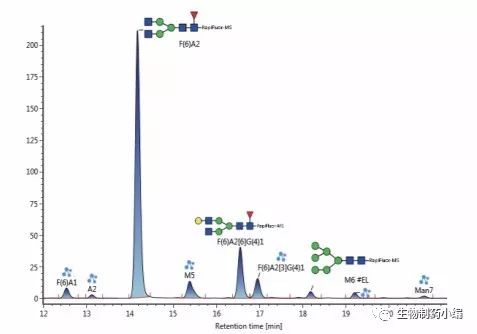
图5:使用Rapid PNGase F释放阿达木单抗的N-糖之后用 RapiFluor-MS标记,然后进行HILIC分离所得的荧光色谱图。
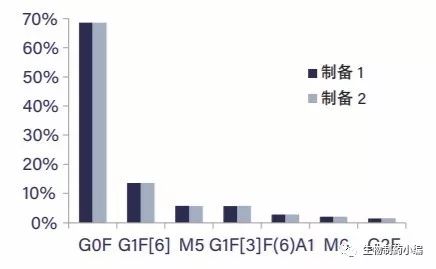
图6:阿达木单抗N-糖的半定量分析:两次单独制备所得的样品 (平均RSD为0.8%)。
西妥昔单抗也具有典型的复杂岩藻糖基化双天线糖基和高甘露糖糖基(G0F、G1F、G2F、Man5、Man6)。 然而,我们还观察到了大量其它物质,最明显的是由 Neu5Gc(“Sg”)或Gal-α1,3-Gal(“Ga”)糖封端的复杂双天线或三天线游离寡糖,其中丰度最高的是G2FGa2、 G2FGa1Sg1、G3FGa3、G3FGa2Sg1和G2FSg2。此外还检测到了低浓度Neu5Ac封端的游离寡糖。
请注意,RapiFluor-MS标记在荧光检测和质谱检测中灵敏度极高,使得低强度游离寡糖得以检出且精度极佳。例如,占西妥昔单抗糖基化比例0.1%的A1糖基在荧光和质谱图中都能明确检出(图7)。所得质谱图非 常清晰,确证了基于GU的鉴定结果,误差仅为0.5 ppm。
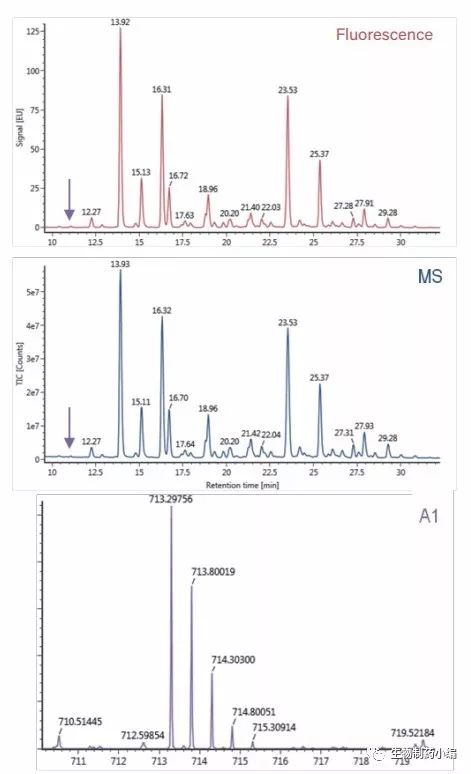
图7:西妥昔单抗游离N-糖的荧光(上图)和MS(中图)HILIC色谱图, 以及A1的质谱图(0.1%相对强度,质量误差0.5 ppm,下图)。紫色 箭头标示了A1的色谱峰。
与2AB相比,采用RapiFluor-MS通常可观察到更高的电荷态,其荧光和MS灵敏度也更高,因此RapiFluor-MS还非常适用于最大m/z值(1250)和灵敏度有限的 QDa质谱检测器(沃特世)。因此,无需高分辨率质谱仪即可通过GU校准和质量数确证进行游离N-糖分析。 图8展示了QDa质谱检测器与Empower 3控制的 UPLC(沃特世)联用分析阿达木单抗游离N-糖所得的荧光和质谱图。
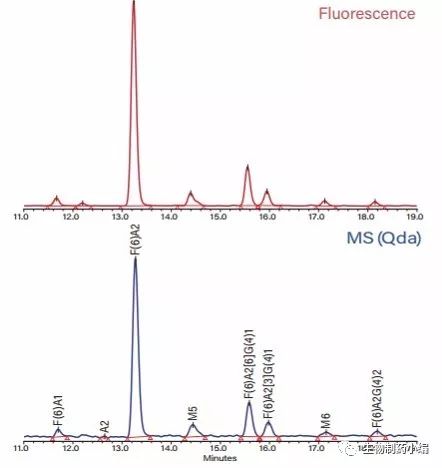
图8:阿达木单抗游离N-糖的荧光(上图)和MS(QDa质谱检测器; 下图)HILIC色谱图。
唾液酸化定量分析
术语“唾液酸”涵盖了40多种神经氨酸结构,其中N-乙 酰神经氨酸(Neu5Ac)和N-羟乙酰神经氨酸(Neu5Gc) 是最常见的生物治疗药物。它们一般通过连接末端半乳糖残基来封端糖基的非还原末端。Neu5Ac是我们所需的人类唾液酸化物质,但Neu5Gc却是药物中不 应含有的非人类变体。二者均可使用乙酸化学释放唾液酸,经DMB荧光标记后直接定量,且最少只需 10 µg mAb。
我们将该方法应用于西妥昔单抗分析,在反相模式下对标记的唾液酸进行色谱分离。通过比对唾液酸参比 数据库轻松完成鉴定。使用带标记的Neu5Ac标准品 进行外标校准,实现覆盖三个数量级的定量分析(图 9)。
表2:西妥昔单抗唾液酸化绝对定量的分析条件。
与游离N-糖分析的预期结果类似,我们成功检出了 Neu5Gc以及浓度更低的Neu5Ac。它们分别占西妥 昔单抗分子量的0.21%和0.01%,与之前得到的N-糖 谱图一致。该结果不容忽视,因为这表明每个mAb 分子平均带有约一个Neu5Gc。
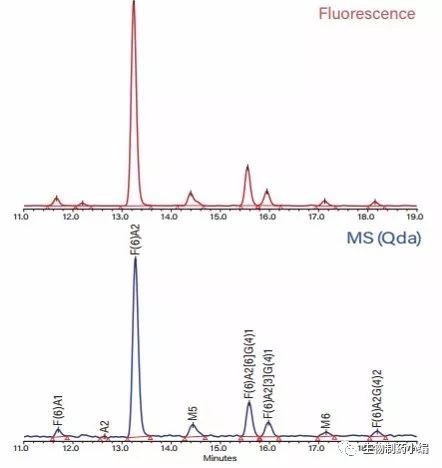
图9:DMB标记的Neu5Ac标准品(从浅蓝色到深蓝色,浓度逐渐提 高)、DMB标记的唾液酸数据库参比物(绿色)和游离的DMB标记西 妥昔单抗唾液酸(红色)的荧光色谱图。
位点依赖型N-糖分析
N-糖基化位点通常很容易鉴定,因为它们位于已知 的共有序列中:Asn-X-Ser或Asn-X-Thr,其中X表示除脯氨酸以外的任意氨基酸。Humira®中有一个常见 于IgG1 mAb的共有序列(位于重链Fc部分的301Asn)。相比之下,西妥昔单抗有两个共有序列,二者的糖基 化类型在重链上存在差别。肽图分析是在氨基酸水平测定和分析糖基化位点的首选方法,同时还可验证抗体序列。
通过蛋白质变性、还原、半胱氨酸烷基化以及最后的酶解可得到肽。对西妥昔单抗进行典型的胰蛋白酶酶解会产生相当长的肽(含16个氨基酸;烷基化后的分子量为1906 Da),其中包含Fab糖基化位点。可以预 见的糖基化异质性以及某些实测游离寡糖的高分子量 (从G3F到G3FSg3,约2000~3000)将增加检测这些 糖型的难度。因此,我们采用三重酶解法(胰蛋白酶、 Glu-C和Asp-N),这种方法具有裂解位点特异性,可 确保获得小分子肽(两个位点均可得到含7个氨基酸的肽;烷基化后的分子量小于950 Da)。
经大孔径HILIC色谱柱洗脱后,利用MS准确鉴定了肽段(质量误差小于5 ppm),该色谱柱可完全分离糖基化肽与非糖基化肽,有助于前者的检出(图10)。利用高能量MSE数据可检出并确证肽的每种糖基化变体。 另外,使用基于保留时间的过滤器排除潜在的假阳性鉴定结果(例如,低保留时间处的糖基化肽)。
表3:利用大孔径HILIC/ESI-Q-TOF分析西妥昔单抗肽段的分析条件。
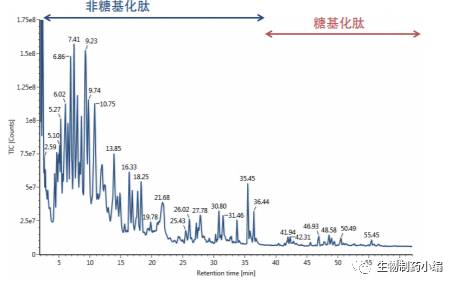
图10:使用大孔径HILIC分离三重酶解所得的西妥昔单抗肽得到的 总离子流色谱图。
采用这种方法,我们获得了接近100%的西妥昔单抗 序列覆盖率(图11)。鉴定结果表明,轻链的C端肽为 GE214C,而非其它文献报道的G213A (Cancer Cell 2005, 7:301-311 and Anal.Chem.2008, 80:1737-1745)。 更有趣的是,每个糖基化位点都能与糖基化谱图相关 联。来自Fc亚基的Asn的谱图与Humira之一(G0F、 G1F、G2F、Man-5和低水平的Neu5Ac唾液酸化)类 似,而在Fd区域,除了这些典型的mAb糖基之外, 还有由Gal-α1,3-Gal和Neu5Gc单糖封端的大型糖基 (通过游离N-糖分析证实)。

图11:使用大孔径HILIC色谱柱对西妥昔单抗进行肽图分析的序列覆盖率。糖基化肽以粗体显示,修饰Asn残基以红色显示。
亚基分析
完整蛋白质分析是一种简单直接的mAb分析方法, 因为它无需任何样品制备步骤。利用MaxEnt1算法对原始m/z信号进行去卷积处理,可得到分子量。然而, 由于所分析的mAb具有分子量异质性,分离度可能不足以得到令人满意的表征结果。
表4:采用大孔径HILIC色谱柱分析Humira®和Erbitux®亚基的分析条件。
图12展示了西妥昔单抗的完整蛋白质分析结果,所用大孔径HILIC色谱柱与前文所述的肽图分析实验相同。 含0.1% TFA的流动相可使mAb的酸性残基完全质子化, 并使碱性残基完成离子配对,从而形成疏水性屏障, 由mAb糖基化来决定保留特性。因此,完全及部分无糖基化的西妥昔单抗变体会比天然形态更快洗脱。 尽管该方法可用于证实糖基的存在与否并提供完整 mAb的分子量,但不足以确定所述糖基的性质。要完成上述鉴定,必须大幅提升色谱分离度和MS分辨 率。这两点均可通过亚基水平的分析实现。相较于完 整mAb,25 kDa左右的亚基异质性更低,而通过 IdeS酶解和原位还原可快速获得亚基。
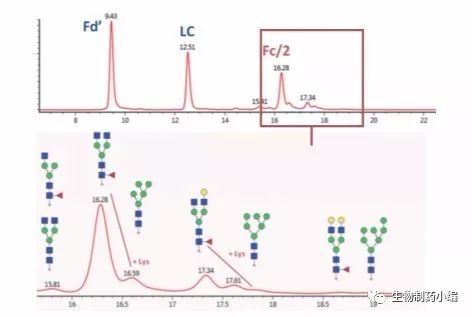
图12:采用大孔径HILIC色谱柱分离Humira®亚基得到的荧光色谱图 (上图),以及放大后的Fc/2亚基糖基化变体谱图(下图)。
IdeS裂解lgG1铰链区分子间二硫键的C端侧,得到 Fc/2和F(ab’)2亚基,接下来可将F(ab’)2亚基还原为组成该亚基的轻链和Fd’亚基。
Humira亚基在HILIC大孔径色谱柱上得以完全分离, 更重要的是,Fc/2的糖基化变体也实现了分离,因 此可进行N-糖分析。
对于西妥昔单抗,有两种亚基发生了糖基化,即 Fc/2和Fd'。因此,亚基水平的分析更具价值,因为它能给出每个位点的N-糖谱图。相较于分析阿达木 单抗时采用的通用梯度方案,我们对梯度进行了扩展, 目的是改善所有糖基化亚基变体的分离度(图13)。
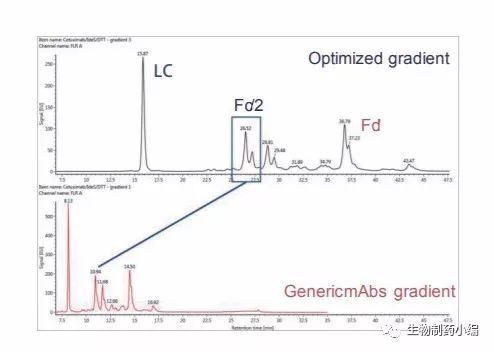
图13:优化梯度后(上图)和优化梯度前(下图)采用大孔径HILIC色 谱柱分离西妥昔单抗亚基所得的荧光色谱图。
总共鉴定出38种物质:13种来自Fc(图14),25种来 自Fd’(图15),与其它水平的分析结果完全一致。由 于保留特性主要取决于糖基区域而不是肽,Fc和Fd’ 亚基的糖蛋白共洗脱。 请注意,在上述所有完整蛋白质及亚基分析示例中, 除了MS之外,我们还利用mAb的固有荧光检测来监 测洗脱过程,所得色谱图非常清晰,对低丰度物质的 检测灵敏度也极高。
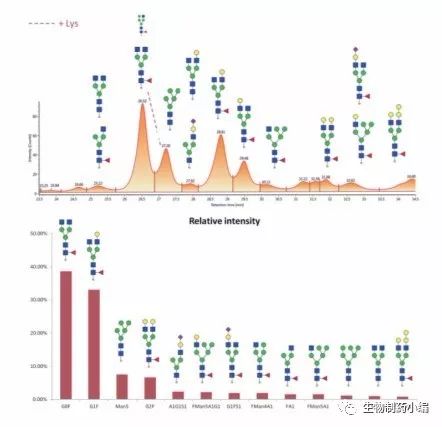
图14:采用大孔径HILIC色谱柱分离西妥昔单抗Fc/2亚基得到的荧 光色谱图(上图)以及对应糖型的相对定量结果(下图)。
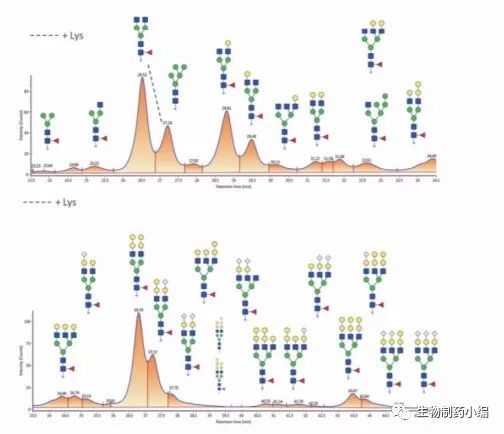
图15:采用大孔径HILIC色谱柱分离Humira西妥昔单抗Fd’亚基得到 的荧光色谱图(上图和中图)以及对应糖型的相对定量结果(下图)。
结论
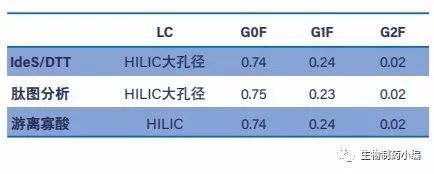
本研究将亚基、肽和游离寡糖水平的多种分析方法相 结合,形成一套全面工作流程,成功对阿达木单抗和 西妥昔单抗N-糖基化进行了全面表征,同时获得了 出色的一致性(表5)。
表5:Humira中G0F、G1F和G2F在三个分析水平的相对含量。
使用RapiFluor-MS标记试剂盒(沃特世)在一天内就完成了N-糖分析,所得结果与文献结果完全一致。 仅使用少量mAb样品,通过简单直接的酸诱导释放和DMB标记方法成功定量了Neu5Ac和Neu5Gc唾液 酸化,所得结果与之前测定的N-糖基化谱图一致。
通过三重酶解得到短肽段(序列覆盖率100%),然后 利用大孔径HILIC/MS分析了所有N-糖基化位点。 这种固定相可完全分离糖基化肽和无糖基化肽,MSE 数据则能够确证糖基的存在。我们证实西妥昔单抗的两个糖基化位点之间存在显著差异,完整谱图与游离寡糖分析结果一致。
通过IdeS酶解及随后的原位还原得到mAb亚基,亚基分析结果确证了糖基化谱图及糖基化位点的位置, 这种样品制备方案比肽图分析方法更简单、更快速。 糖基化及其它翻译后修饰造成的重大异质性可能会增 加亚基分子量确证的难度,而这种方法可用于这些亚 基分子量的确证。
这一全面工作流程完全适用于几乎任何mAb或ADC,所需样品量很少且分析时间较短。Quality Assistance还采用其它分析方法来完善治疗性mAb糖基化研究,包括岩藻糖基化的相对定量、基于混合模式色谱的唾液酸化分析以及MALDI-TOF分析等。
注:本文引自Quality Assistance的应用文章。