
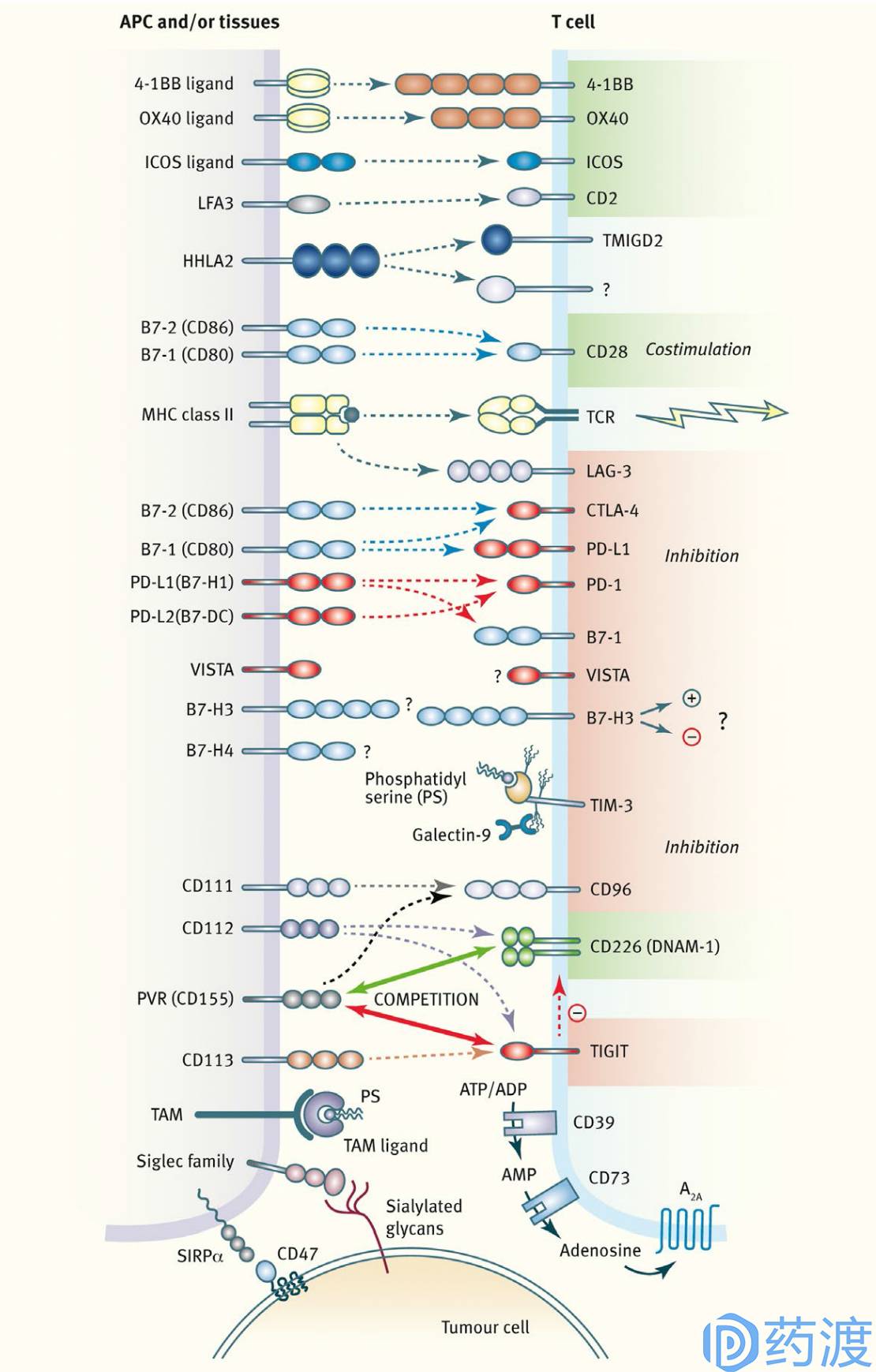
Overview of innate and adaptive checkpoint pathways
免疫治疗是指通过免疫系统达到对抗癌症目的的治疗方式,也是生物治疗的一种。识别和杀死异常细胞是免疫系统的天然属性,但是癌症细胞经常有逃避免疫系统的能力。过去几年,癌症免疫领域的快速发展产生了几种治疗癌症的新方法,通过增强免疫系统中某些成分的活性或者解除癌症细胞对免疫系统的抑制来发挥作用。广义的免疫治疗包括免疫检查点抑制剂、免疫细胞治疗、溶瘤病毒、治疗性抗体、癌症疫苗以及免疫系统调节剂。肿瘤免疫治疗近来备受关注,除了手术、化疗及放疗外,已成为癌症治疗的重要手段。Ipilimumab及nivolumab / pembrolizumab是最早上市的免疫检查点抑制剂类药物,分别靶向于CTLA-4及PD-1;在治疗非小细胞肺癌及黑色素瘤领域已逐渐从二线转变为一线治疗药物。免疫治疗药物并非没有弱点,药物的试用可能会诱导肿瘤细胞额外免疫检查点活性的上调,凸显了开发新型抗肿瘤免疫激活剂的重要性。新出现的药物不仅通过封闭免疫抑制性检查点或作为免疫刺激信号通路的激活剂而靶向于获得性免疫淋巴细胞,还可靶向于先天免疫过程中的巨噬细胞和自然杀伤细胞,两者广泛存在于多种类型的实体瘤及血液系统癌症中。本文将对新出现的进入临床研究或临床前研究的肿瘤免疫治疗靶点做一概览。
表1. Summary of past and current clinical trials in cancer for immune checkpoint agents
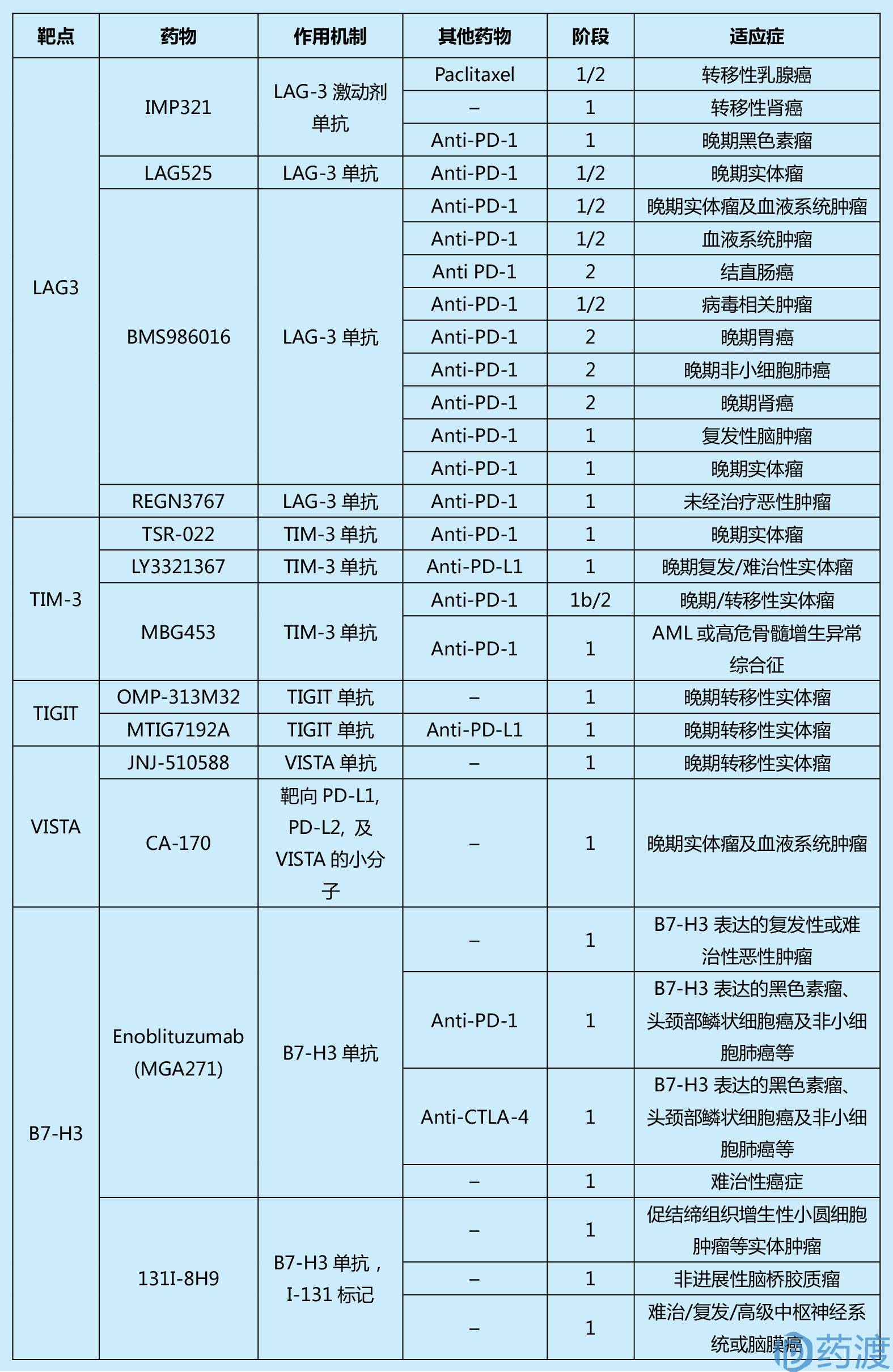
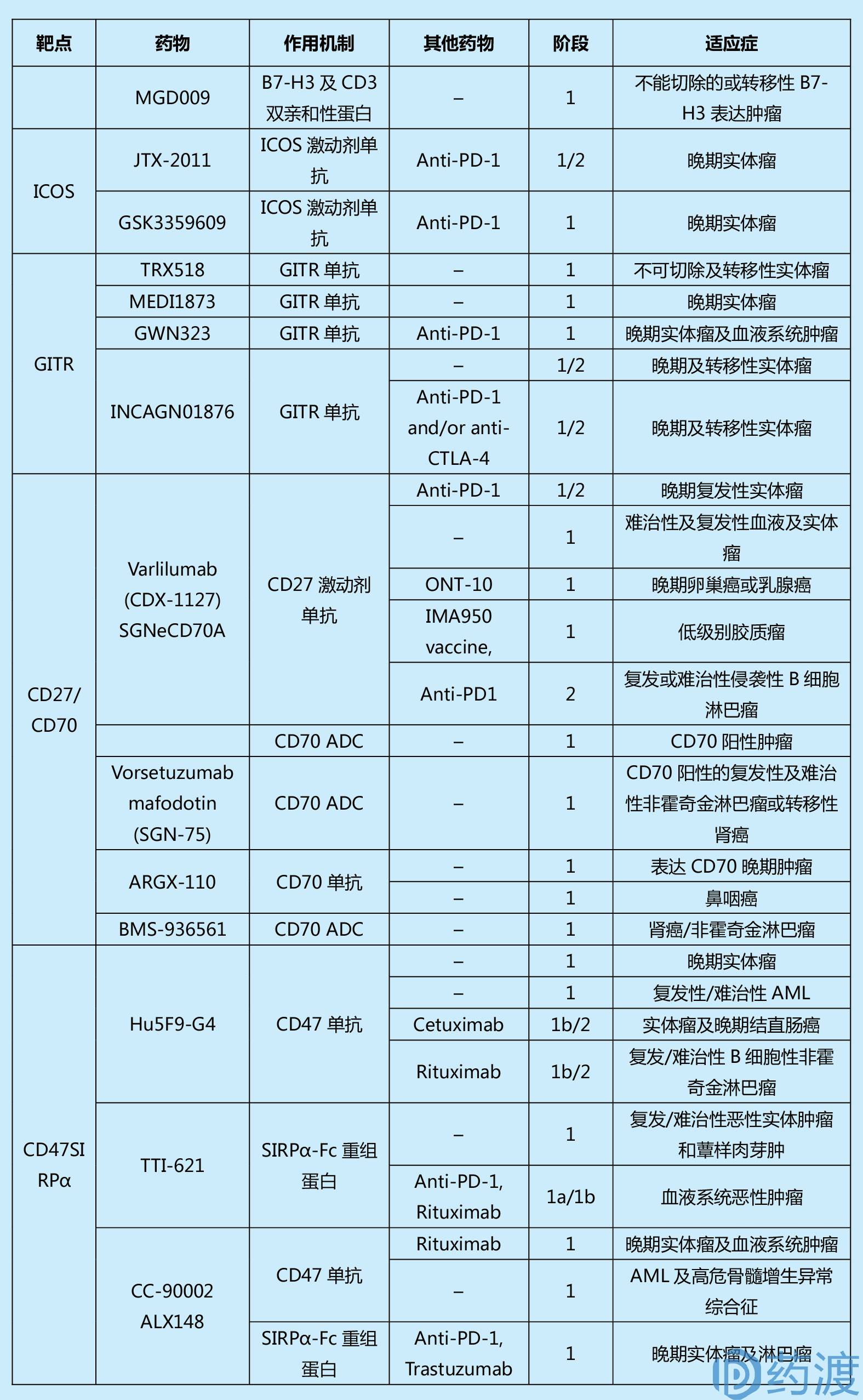
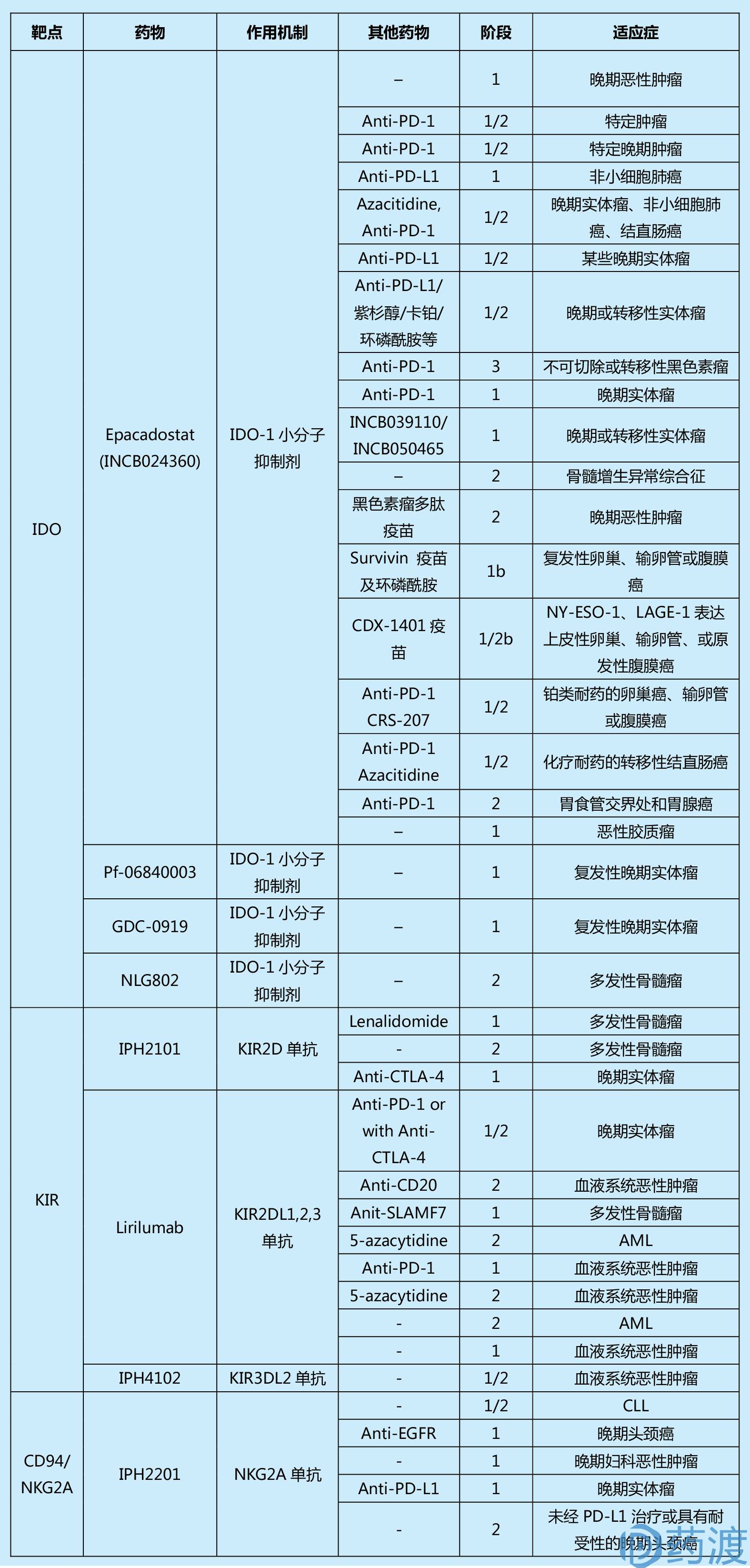
(本表来源于文献1,篇幅所限,对更多信息感兴趣的读者可查阅原文)
获得性免疫-抑制性淋巴细胞受体
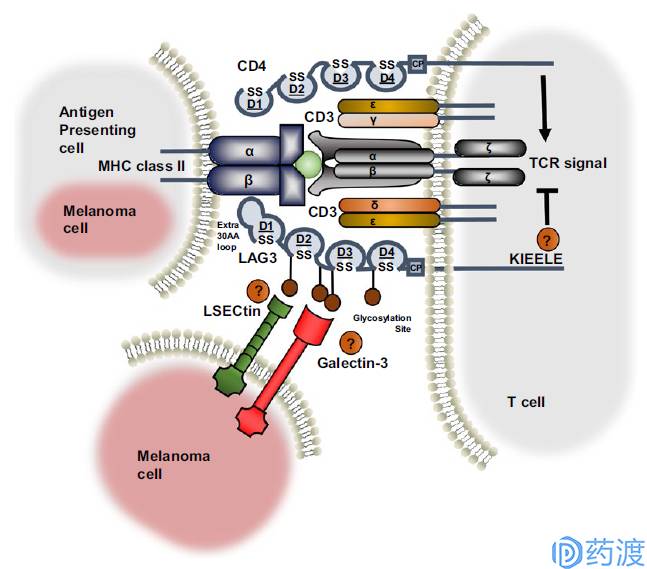
Ligand interaction and structural similarities between LAG3 and CD4
LAG-3
LAG-3 (lymphocyte activation gene 3,LAG-3,CD223)和CD4是同源蛋白,但是以更高的亲和力与主要组织相容性复合体Ⅱ类分子(major histocompatibility complex classⅡ,MHCⅡ)结合,主要表达在活化的T淋巴细胞、B淋巴细胞、自然杀伤细胞(natural killer cell,NK)和浆细胞样树突状细胞(plasma cytoid dendriticcells,pDCs),并负调控T细胞功能。研究表明LAG-3选择性地上调Treg表面的CD4,因此LAG-3抗体在体内可降低Treg活性。抑制或敲除LAG-3会解除Treg对T细胞的抑制功能。另外,在缺少CD4+T细胞的情况下,LAG-3抗体能够增加CD8+T细胞的功能。T细胞失能或者耗竭时会表达多种免疫检查点分子,在慢性感染模型及自身抗原识别模型中LAG-3和PD-1通常都有共表达现象。协调抑制LAG-3及PD-1能够增强免疫应答,因此目前关于LAG-3抗体的临床试验都是单独或者与PD-1联用来观察效果。目前主要有以下几家公司进行LAG-3的临床试验:BMS的BMS986016,Regeneron和Sanofi合作的REGN3767,Novartis的LAG525及Immuntep的IMP321等。
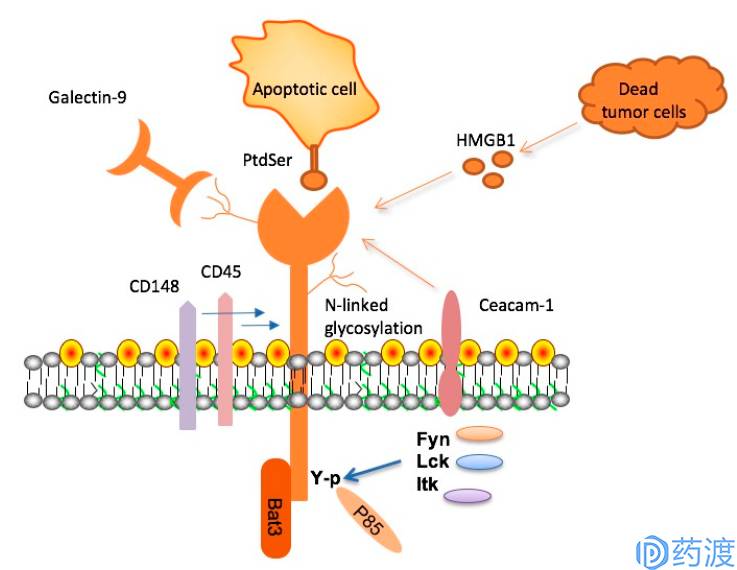
TIM-3, its ligands and signaling adaptor proteins
TIM-3
TIM-3是TIM家族的一个受体蛋白,在T细胞、Treg细胞、先天免疫细胞(树突细胞、自然杀伤细胞、单核细胞)表面表达。TIM-3有多种配体,如磷脂酰丝氨酸(phosphatidylserine)、半乳凝素9 (galectin-9)、HMGB1和CEACAM-1。和其他免疫检查点分子不同的是,TIM-3并非在所有T细胞激活后得以上调,仅在CD4+辅助T细胞1 (Th1)和 CD8+细胞毒性T细胞中上调,参与协同抑制作用。在由其配体galectin-9激活后,TIM-3会抑制效应T细胞的活性,并引起外周耐受。TIM-3在T细胞在肿瘤中的损耗中起着关键作用。TIM-3在用抗PD-1治疗产生耐药性的动物的T细胞中高表达。在独立实验中,当抗TIM-3抗体与抗PD-1药物联用时可抑制抗PD-1治疗耐药性的产生。目前在临床试验的TIM-3抗体有Tesaro的TSR-022、诺华的MBG-453及礼来的LY3321367。
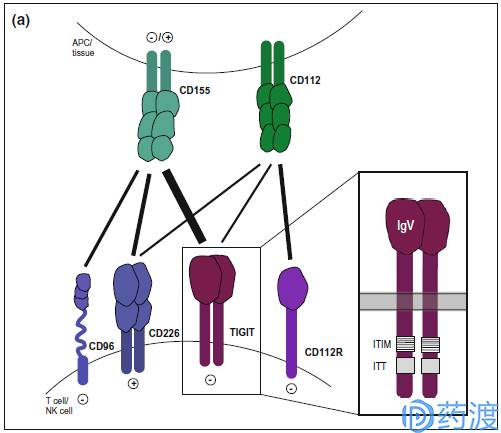
TIGIT pathway
TIGIT
TIGIT(又叫Vsig9,Vstm3,WUCAM),是含Ig及ITIM结构域的T细胞和NK细胞共有的抑制性受体,是Ⅰ型跨膜蛋白,包括IgV胞外段以及免疫球蛋白酪氨酸尾巴样磷酸化片段。TIGIT和CD226 (DNAM-1)竞争结合配体CD155 (PVR,NECL5)和CD113 (PVRL3,nectin-3)。体外阻断TIGIT后能增强NK和T细胞的活化及脱颗粒水平,并且也能增加细胞因子如IFN-γ的分泌;不同小鼠肿瘤模型中,TIGIT在NK和T细胞上表达显著上调。目前在临床研究的TIGIT抗体主要是Genentech的MTIG7192A及Genentech的MTIG7192A / RG6058,单独或者和PD-L1抗体Atezolizumab联用治疗晚期或者转移性肿瘤。

Human cancer immunotherapy strategies targeting B7-H3
B7-H3
也称CD276,属于I型跨膜蛋白,胞外区包含两对相同的免疫球蛋白可变区和恒定区,胞内区很短,没有明确的信号基序。其mRNA水平的表达较为广泛,但蛋白表达相对局限在静息的成纤维细胞、内皮细胞、成骨细胞、羊水干细胞等非免疫细胞,以及受诱导的抗原提呈细胞、NK细胞表面。许多研究揭示B7-H3在多种肿瘤中过表达,包括黑色素瘤、白血病、乳腺癌、前列腺癌、结直肠癌及其它肿瘤等,表达水平与患者预后不良和临床转归差密切相关,推测其参与了肿瘤的免疫逃避。虽然其分子机制还不明确,但作为一种可能的免疫检查点分子,是一个有前景的肿瘤免疫治疗靶标。
MacroGenics公司的Enoblituzumab (MGA271)的抗肿瘤作用是通过抗体依赖的细胞介导的细胞毒性作用(ADCC)发挥效用,已经进入到I期临床试验,并显示令人鼓舞的初步结果。抗体-药物偶联物(ADC)可起到生物导弹的作用,放射标记靶向B7-H3的单抗8H9成功用于转移性神经细胞瘤的临床治疗,而放射标记的人源化8H9抗体正用于开展腹膜癌、神经胶质瘤以及中枢神经肿瘤的临床试验。双特异抗体、嵌合抗体受体T细胞(CAR-T)、小分子抑制剂的开发丰富了肿瘤免疫治疗的策略,联合应用促进协同效应,进一步对其受体和机制的研究为设计更有效的治疗药物奠定基础。
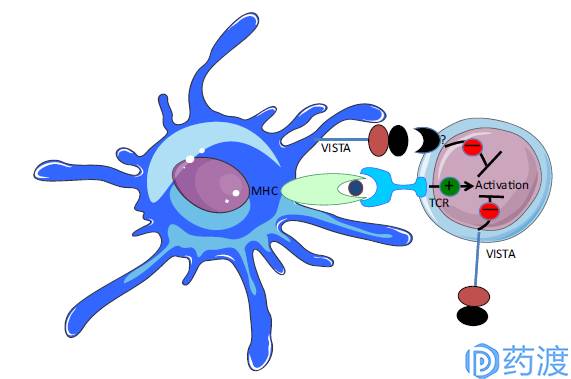
VISTA exerts an inhibitory effect on T cell activation
VISTA
VISTA (V-Domain Immunoglobulin-Containing Suppressor of T Cell Activation)属于免疫球蛋白家族,胞外结构域和PD-L1同源。人源的VISTA主要表达在CD4+细胞、CD8+T细胞、CD11b+亚群的单核细胞、淋巴细胞、骨髓细胞、树突细胞亚群和中性粒细胞。目前VISTA的细胞表面受体尚不清楚。VISTA对于抗原呈递细胞和T细胞有抑制作用。目前在临床阶段的VISTA抗体是强生的JNJ-61610588及Curis的小分子药物CA-170。
获得性免疫-淋巴细胞共刺激分子受体
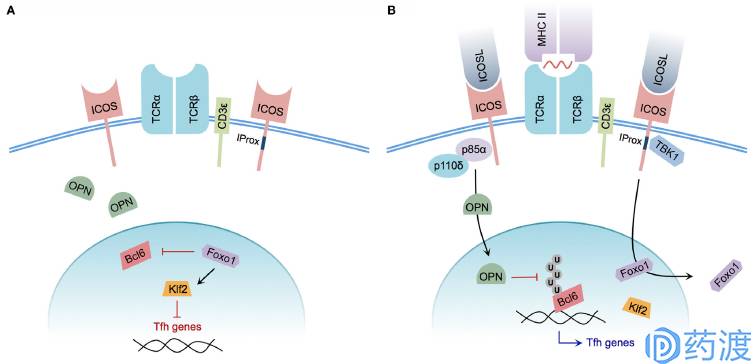
Model of ICOS-mediated Tfh cell differentiation
ICOS及ICOS-L
ICOS是新发现的一种共刺激分子,诱导表达于活化后的T细胞上。ICOS和CD28和CTLA-4同源,被认为是CD28家族的第三个成员。ICOS提供的共刺激信号能促进T细胞增殖,调节T细胞的分化,维持活化后T细胞(包括记忆性T细胞)的效应和功能,参与T/B协同,影响Ig类型转换。目前认为CD28在免疫应答的启动中发挥重要作用而ICOS则在应答的后期及维持效应阶段起更主要作用。ICOS的配体ICOSL(又称B7-H2、GL50,在小鼠上称为B7h、B7RP-1)和B7-1/B7-2具有较高同源性,被归为B7家族5-7。主要表达在B细胞上,在DC和Mφ上也有表达。但ICOSL不仅仅表达在造血细胞上,当受到炎症刺激时也表达于其他一些组织细胞上,这点和B7-1/B7-2不同。目前有两类候选药物JTX-2011及GSK3359609正在分别与不同的PD-1单抗药物开展联合用药的临床一期研究。
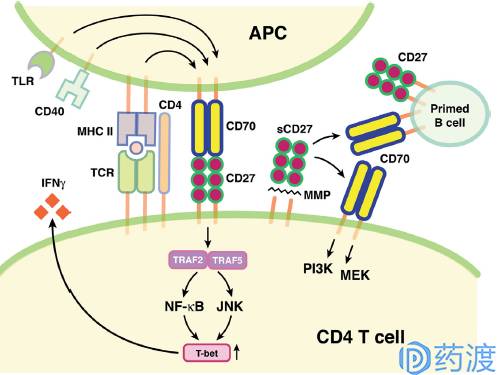
CD27–CD70 pathway in immune regulation
CD27及CD70
TNF受体超家族对免疫上调的作用机制不同于B7/CD28免疫共刺激相互作用。这其中知名度比较高的成员为CD27,特异性的表达在淋巴细胞中。当被激活时,CD27会大量表达在细胞表面。CD27信号会受到配体CD70表达水平的限制,后者受限于T细胞、B细胞及树突状细胞的抗原受体激活。CD27 / CD70信号能够促进T细胞的克隆扩增和存活,促进效应和记忆T细胞分化,增强B细胞和NK细胞的活化和功能。
在转基因小鼠模型中,CD70的持续性表达能够激活CD27/CD70信号通路,上调效应T细胞并防止肿瘤的发展。在临床前的免疫功能正常的小鼠模型中,CD27激动剂治疗也可阻止肿瘤的形成及发展。Varlilumab是一种靶向于CD27的全人源单克隆抗体,目前处于治疗恶性黑色素瘤和实体瘤临床二期研究,治疗肾细胞癌的临床一/二期研究以及治疗血液系统恶性肿瘤和前列腺癌的临床一期试验阶段。该药物曾进行过治疗乳腺癌和卵巢癌的临床一期试验,但该研究目前已终止。针对CD70的治疗方案,目前由三类抗体偶联药物及一种单抗类药物处在临床研究中。
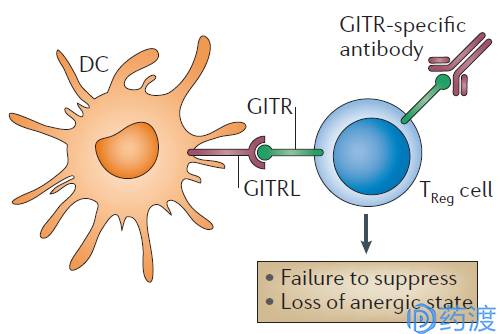
Initial hypothesis concerning the effects of GITR signalling on TReg cells
GITR
GITR是指糖皮质激素诱导的肿瘤坏死因子受体(glucocorticoid—induced tumor necrosis factor receptor,GITR)蛋白是TNFR超家族的新成员,它最初于1997年在杂交瘤细胞株上由Nocentini等克隆出来。1999年又分别由两组科学家克隆得到与鼠GITR类似的人GITR以及其配体(GITR ligand,GITRL)。到目前为止,人们对GITR信号在后天免疫系统的作用研究较多。GITR同GITRL的结合可以一直Treg细胞活力,并刺激效应T细胞;因而对于肿瘤免疫治疗而言,活化GITR是比较有潜力的策略之一。
多项在实体瘤小鼠模型中开展的临床前研究都报道了小鼠GITR激动剂DTA-1在体内的活性。GITR激动剂同其他免疫调节剂的联合用药会提高整体抗肿瘤效果。一个最有趣的发现是,GITR激动剂抑制肿瘤的生长和增加生存率效应不仅出现在免疫原性肿瘤(结肠、膀胱、肺模型,黑色素瘤),还出现且在低免疫原性肿瘤(乳腺癌、黑色素瘤的小鼠模型中,卵巢癌等)中,从而使得GITR激动剂相比其他免疫检查点抑制剂类药物具有独特的优势。免疫组化及流式细胞实验表明,GITR在多种人类实体瘤中都有表达。在乳腺癌和子宫内膜癌患者中,GIRT在Treg细胞中的表达量要高于外周血。目前至少有四种GITR激动剂类药物进入早期临床研究阶段,单独用药伙同其他免疫检查点抑制剂联合用药。
先天免疫-巨噬细胞检查点
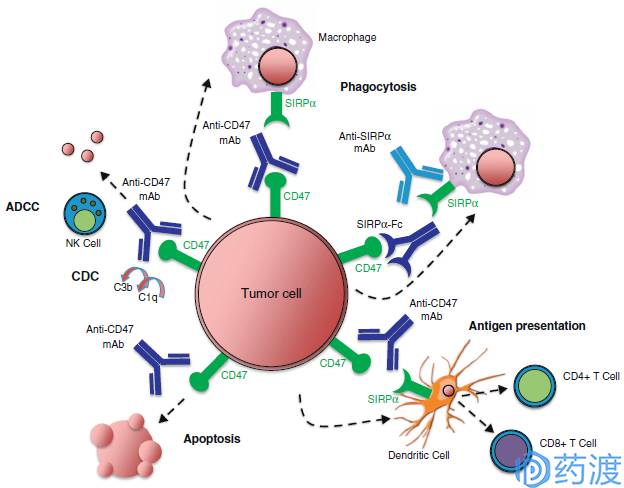
Mechanisms of targeting the CD47–SIRPα pathway in cancer
CD47及SIRPα
CD47也被称为整合素相关蛋白(integrin associated protein,IAP),是免疫球蛋白超家族成员。CD47广泛的表达于细胞的表面,可与信号调节蛋白α (Signal regulatory protein α,SIRP α)、血小板反应蛋白(thrombospondin-1,TSP1)以及整合素(integrins)相互作用,介导凋亡、增殖、免疫等一系列的反应。2000年,Oldenborg等人证实CD47是细胞表面一个重要的"self"标记,是调节巨噬细胞吞噬作用的一个重要信号。CD47可以与巨噬细胞表面SIRPα结合,磷酸化其ITIM,随后招募SHP-1蛋白,产生一系列的级联反应抑制巨噬细胞的吞噬作用。肿瘤细胞有一系列躲避人体免疫系统追杀的方案,包括分泌免疫抑制因子、下调MHC I表达,以及上调PD-L1抑制CD8+T细胞活性。不同的研究表明,几乎所有的肿瘤细胞和组织都高表达CD47,是对应正常细胞和组织的3倍。
目前处于临床一期阶段的三个药物分别为Forty Seven的Hu5F9-G4、Celgene的CC-90002(来自Inhibrx,原代码为INBRX-103)以及Trillium的TTI-621。值得一提的是,Trillium Therapeutics的CD47抗体项目为SIRPαFc融合蛋白,与Hu5F9-G4具有相类似的CD47亲和力(nM级别)。而SIRPαFc具有两大优势:首先是其分子量更小约80kDa,相对于抗体分子的150kDa具有更好的穿透性和组织分布性;其次SIRPαFc对于红细胞的亲和力要远远低于Hu5F9-G4,表明其可能具有更好的安全性。在CD47抗体的肿瘤治疗领域,Trillium Therapeutics的SIRPαFc融合蛋白也许会有差异化的优势。
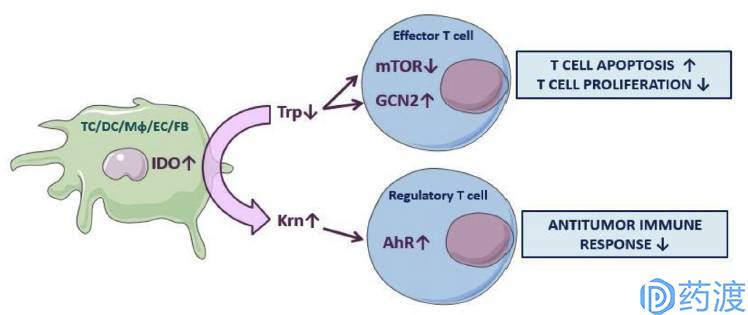
Mechanisms of IDO pathway activity inimmune tolerance
IDO
吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)由403个氨基酸残基组成,是除了肝脏以外的细胞内唯一可催化色氨酸吲哚环氧化裂解,使其沿着犬尿氨酸途径(kynureine pathway,KP)分解代谢的限速酶。人免疫系统中主要执行功能的是效应T细胞,而Treg Cell(调控T细胞)则会起到一个负调节的作用。所以,肿瘤细胞要进行免疫逃逸,主要就是通过抑制效应T细胞以及激活Treg Cell。IDO调控免疫耐受的机制,目前主要有三种:第一个机制是,色氨酸的缺乏会抑制效应T细胞中mTORC1和PKC两条信号通路,从而造成效应T细胞能量缺乏,生长阻滞和凋亡。第二个机制,色氨酸的短缺,会造成细胞中集聚大量的未带电荷的色氨酸转移核糖核酸(tryptophan transfer ribonucleic acid),积累的这些非稳态化合物会激活细胞中的应激激酶(GCN2),从而终止效应T细胞的蛋白翻译和激活。最后一种机制,是由于色氨酸被IDO代谢后产生的代谢产物犬尿酸,会结合到AHR这个转录因子上,从而激活了FOXP3 + Treg Cells,从而这些Treg细胞反向地抑制了效应T细胞的活性。IDO的大量表达可以在肿瘤微环境中帮助肿瘤细胞进行免疫逃逸。例如,IDO高表达可抑制T细胞的增殖成熟并诱导其凋亡,从而促进肿瘤的发展等等。IDO表达或活性的异常增高,已被证实与抑郁症、阿尔茨海默病、白内障、癌症等疾病的发病机制密切相关。因此,IDO抑制剂可能成为治疗这些疾病的一种有效方法,已经引起了众多学者和医药公司的关注。
目前有4中IDO小分子抑制剂处在临床研究中,其中epacadostat注册了20个临床试验,包括一项针对黑色素瘤患者的三期临床研究。NewLink公司开发的indoximod在美国处于临床二期研究,与Roche共同开发的GDC-0919在美国也处于一期临床研究阶段。另外,BMS和Pfizer的IDO抑制剂类药物也已进入了临床一期研究。2017年3月24日,恒瑞医药子公司向FDA提交了SHR9146临床注册申请并获手里,该药物为口服强效的小分子IDO抑制剂。
先天免疫-NK细胞检查点
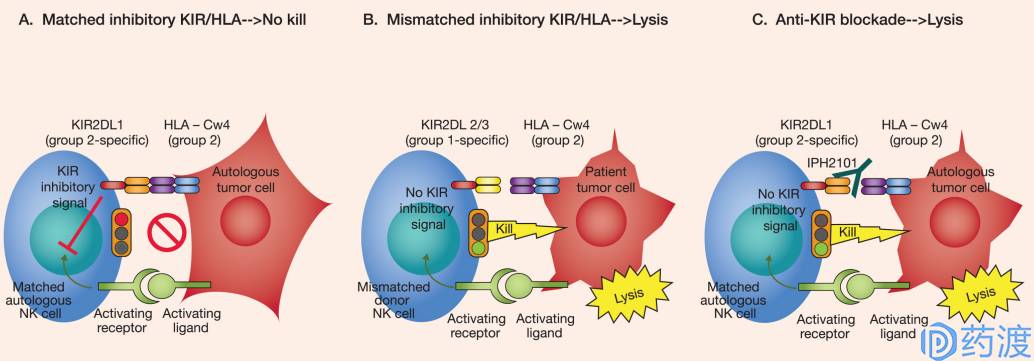
Mechanism of KIR mediated signal
KIR家族
KIR家族是一组表达与大多数NK细胞及一些T细胞表面的具有高度多态性的基因。一些KIR家族成员(KIR2DL1-3,KIR3DL1通过结合至MHC分子(HLA-C/HLA-B)而发挥抑制功能。KIR作为NK细胞家族的调节物,近期成为了多种肿瘤免疫治疗的新靶点。KIR对NK细胞效应器功能起负性调节作用。抑制KIR会引起NK细胞的抗肿瘤活性。
尽管在临床前研究中取得较好结果,KIR2DL1/2/3单抗类抑制剂IPH2101在骨髓瘤患者中开展的1/2期临床研究结果并不理想。KIR2DL1/2/3单抗类抑制剂IPH2102 (lirilumab)目前正在同靶向PD-1或CTLA-4的药物联合用药,在晚期实体瘤及血液系统肿瘤患者中开展1/2期临床研究。
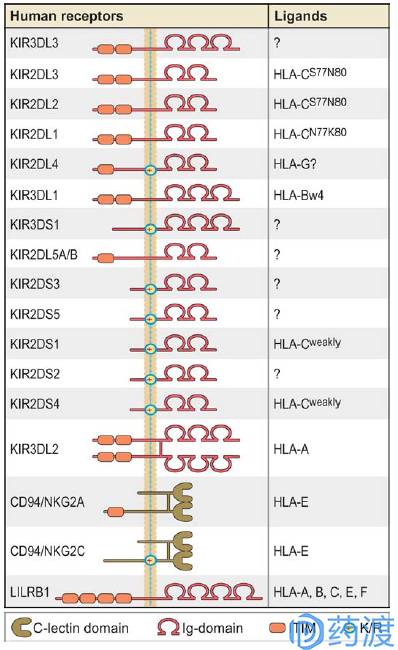
Graphic depiction of human NK cell receptors for MHC class I
CD94/NKG2A
CD94存在于NK细胞表面,可同NKG2A C末端的lectin结构域形成抑制性异源二聚体,也可同NKG2C或E形成激活性异源二聚体。T细胞也可以表达CD94/NKG2A受体,但主要发挥抑制性检查点功能。CD94/NKG2A通过与MHC Ⅰ(HLA-E)的结合来发挥抑制活性,并且该相互作用可通过靶向ERAP-1而被破坏掉。研究发现阻断NKG2A活性能够提高抗体依赖性的细胞毒性,并且过表达HLA-E的实体瘤患者往往预后较差;因而CD94/NKG2A在肿瘤免疫治疗中是一类很有潜力的靶点。目前靶向NKG2A的单抗药物IPH2201至少有六项临床1/2期研究正在进行中,单独用药或同PD-1抑制剂联用来探索对不同晚期癌症患者的疗效。
参考文献:
1. Emergingtargets in cancer immunotherapy. Semin Cancer Biol. 2017 Oct 5. pii:S1044-579X(17)30182-7. doi: 10.1016/j.semcancer.2017.10.001.
2. Introductionto checkpoint inhibitors and cancer immunotherapy. Immunol Rev. 2017Mar;276(1):5-8. doi: 10.1111/imr.12531.
3. Combinationcancer immunotherapy and new immunomodulatory targets. Nat Rev Drug Discov.2015 Aug;14(8):561-84. doi: 10.1038/nrd4591.
4. TargetedTherapy and Checkpoint Immunotherapy Combinations for the Treatment of Cancer.Trends Immunol. 2016 Jul;37(7):462-76. doi: 10.1016/j.it.2016.04.010.
5. CoinhibitoryPathways in Immunotherapy for Cancer. Annu Rev Immunol. 2016 May 20;34:539-73.doi: 10.1146/annurev-immunol-032414-112049.
6. Newcheckpoints in cancer immunotherapy. Immunol Rev. 2017 Mar;276(1):52-65. doi:10.1111/imr.12524.