
2018年1月17日/医麦客 eMedClub/--目前,CAR-T治疗淋巴瘤、白血病等恶性血液肿瘤的优异临床结果,已经相当的令人印象深刻了。但不得不说,这项颠覆性的抗癌疗法仍处于早期发展阶段,在治疗实体瘤方面还面临着很多的挑战。而更好地了解CAR-T细胞持续的重要性也是未来研究的一个重点。毕竟,治疗的目的是为恶性肿瘤患者提供持久的、理想的永久性缓解。

接受CAR-T细胞治疗的Emily(图片来源chop.edu)
在初始治疗时,回输到患者体内的CAR-T细胞能够消除部分恶性癌细胞。但其数量终归是有限的,在这种情况下,如果T细胞能够持续存在并杀死残存的癌细胞以防止临床上明显的疾病进展,那么CAR-T细胞的长期持续性可能是相当重要的。
因此,经过基因修饰的T细胞在体内的稳定扩增和持久性被认为是恶性血液病患者持续临床缓解的重要预测因子。当然,实体瘤患者的持续缓解同样也需要CAR-T细胞显著的体内扩增和长期持续存在。
推荐阅读:
大多数CAR-T细胞治疗实体瘤的总体有效性不够理想的临床试验都报道了T细胞持续性差的问题。而决定CAR-T细胞持久性的因素很多,包括患者的预处理情况、细胞体外培养的条件、T细胞耗竭的产生以及免疫系统对重组蛋白的免疫反应等。与此同时,还需要注意的是,CARs的分子设计也可能会强烈影响T细胞的扩增和持续性,并且是研究工作的重点之一。
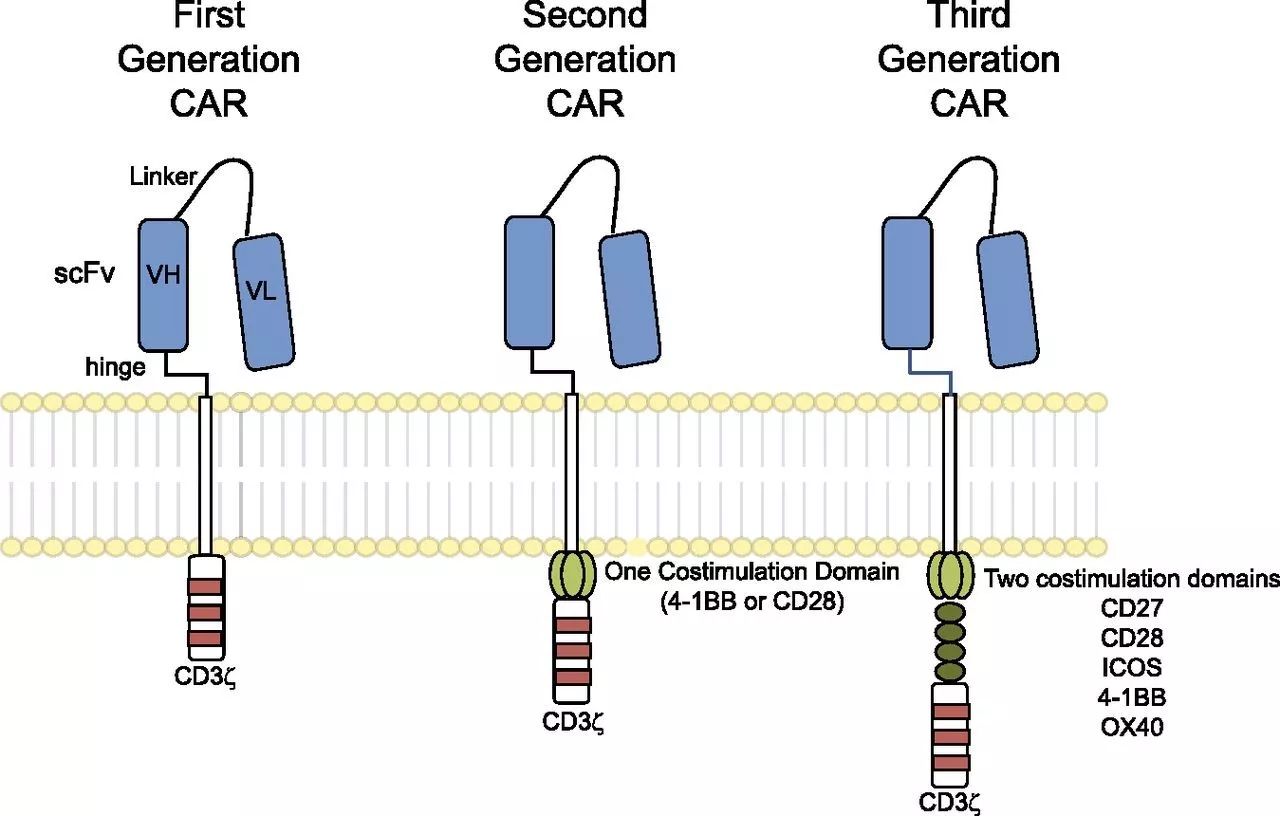
CAR结构(图片来源 blogs.shu.edu)
CAR通常包含3个模块:胞外靶标结合模块、跨膜结构域(TM结构域)和传递激活信号的胞内信号传导域(ICD)。其中跨膜结构域(TM结构域)被认为是主要结构需求,将CAR锚定在细胞膜上,胞内模块通常由T细胞受体CD3ζ链和来自CD28、4-1BB、OX40、CD27或ICOS共刺激蛋白的一个或多个信号传导结构域组成。其中含有CD28或4-1BB共刺激结构域的CAR是迄今为止应用最广泛的,并且已经在临床试验中表现出了显著的反应。一些研究表明CD28细胞内结构域能够刺激更强的CAR-T细胞功能,而4-1BB细胞内结构域能够促进更强的CAR-T细胞持久性。然而,不同的TM(跨膜结构域)和胞内结构域影响T细胞扩增、有效性和持续性的机制并没有完全清楚。
目前,大多数临床试验中使用的CAR-T细胞都是未经选择的T细胞制备的细胞产物。然而,临床前研究表明,不同的T细胞亚型在体内会表现出不同的性质,例如增强的扩增能力和抗肿瘤效果。CD4 + T细胞为CD8 +细胞群提供细胞因子和共刺激作用,增强效应分子的启动、持久性、记忆形成和传递。相关研究已经阐述了包括Th1、Th2、Th9、Th17和Treg等在内的具有不同的扩增和持续体内能力的CD4+ T细胞亚群。然而,CD4 + T细胞是塑性的,这些细胞的表型和功能可以在体内进化。因此,寻找稳定输注细胞表型以保持其有效性和持续性的策略,将会推进细胞治疗领域的显著进步。

Carl June(图片来源 cdn.sandiegouniontrib.com)
近日,由CAR-T元老级人物Carl June教授领导的研究团队在权威学术期刊《JCI insight》发表的最新研究成果表明:通过ICOS和4-1BB刺激能够增强CAR-T细胞的持久性。

在Carl June团队最新的工作进展中,研究人员发现:与含有CD28或4-1BB胞内结构域的CARs相比,ICOS胞内结构域与CARs的结合增强了Th17极化细胞的有效性和体内持续性。
在该项研究中,科学家们假设:CD4 +和CD8+ T细胞亚群需要不同的共刺激信号以获得最佳持续性。结果表明:重新定向的非极化CD4+ T细胞与基于ICOS的CAR显著增强了表达基于4-1BB或CD28的CAR的CD8 + T细胞的持久性。之后,研究人员还评估了包含ICOS和4-1BB胞内结构域的第三代CAR的有效性。有趣的是,在临床前实体瘤模型中,CAR中加入ICOS和4-1BB强烈地增强了CAR-T细胞的持续性和抗肿瘤活性,但只有当ICOS靠近细胞膜并与ICOS TM(跨膜结构域)连接时,这种情况才会发生。
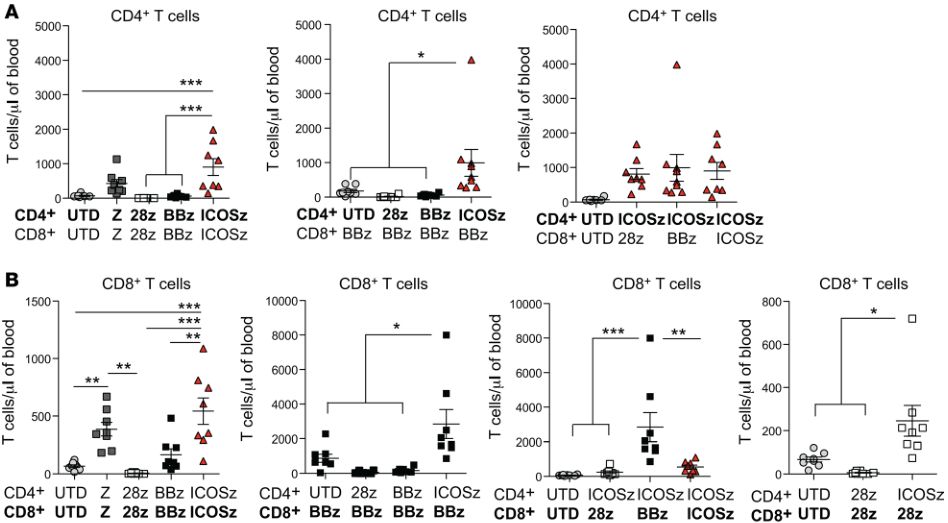
表达基于ICOS的CAR的CD4 + CAR T细胞的辅助效应显着增强共注射的表达基于4-1BB或CD28的CAR的CD8 + CAR T细胞的持续性(图片来源 JCI)
在具体的实验操作中,研究人员将表达不同CAR的CD4+ 和CD8+ T细胞以1:1混合注入到小鼠体内后,发现表达ICOS-CAR的CD4+ T在增加自身持久性的同时,还能够提高共同注射到到小鼠体内的CD8+ T细胞的持久性(在非小细胞肺癌的小鼠模型中获得了最佳的抗癌效果)。
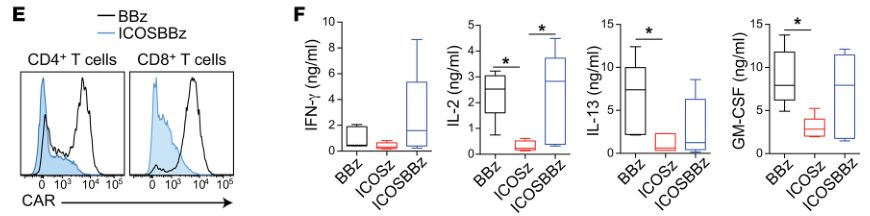
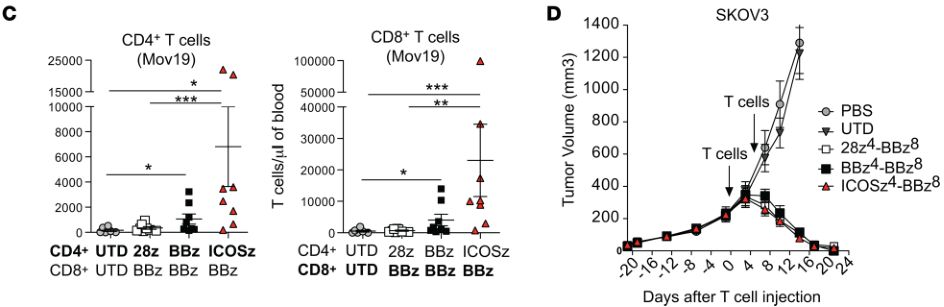
含有ICOS和4-1BB胞内结构域的第三代CAR介导增强的抗肿瘤作用和增加的T细胞持久性(图片来源 JCI)
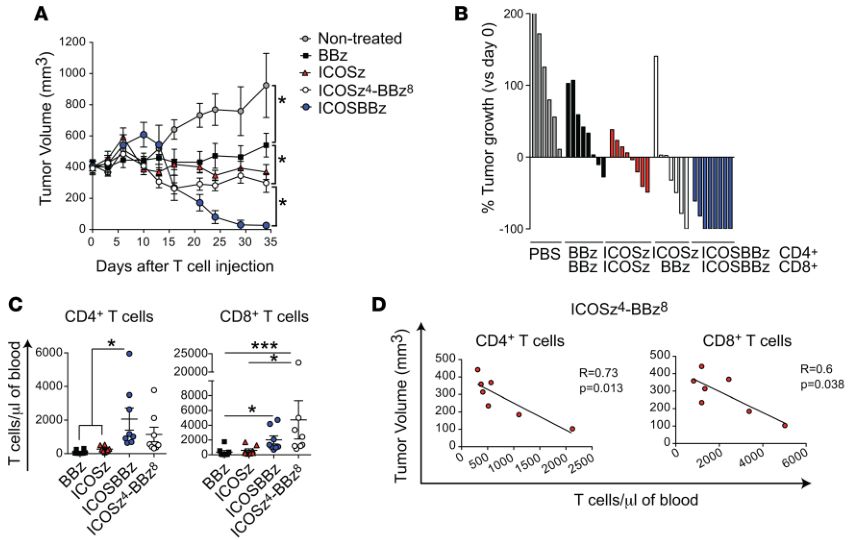
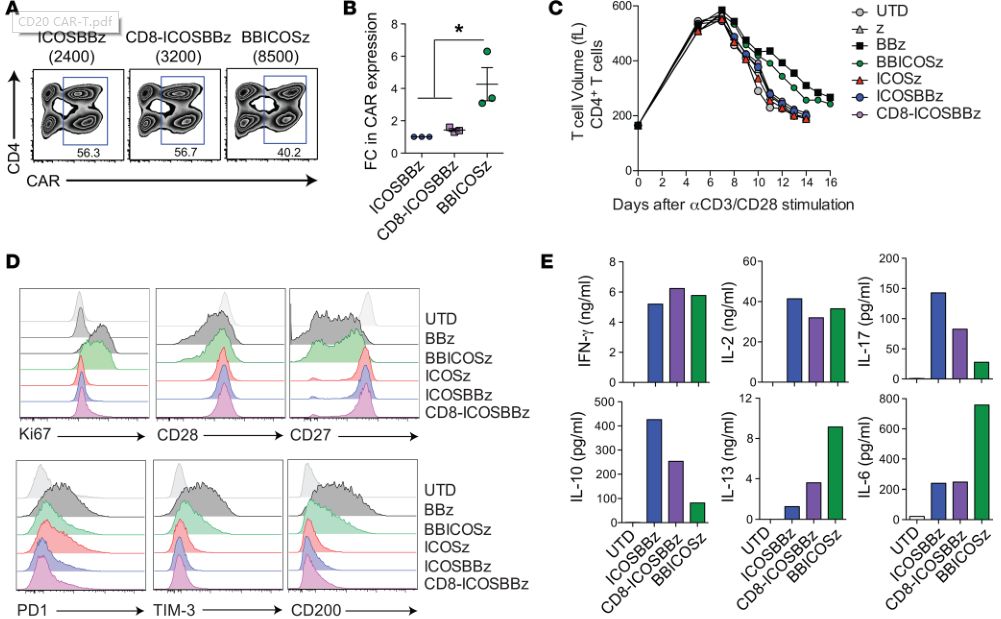
在进一步的研究中(临床前实体瘤模型中),科学家们将ICOS和4-1BB都加入到了第三代CAR-T的胞内结构域(ICOSBBz-CAR),结果表明,相比较于表达ICOS-CAR的CD4+ T细胞与表达BBz-CAR的CD8+ T细胞的组合。当CD4+ 和CD8+ T细胞都表达ICOSBBz-CAR 时,这些T细胞不仅持久性得到了显著的提高,抗肿瘤疗效也达到了最佳水平。
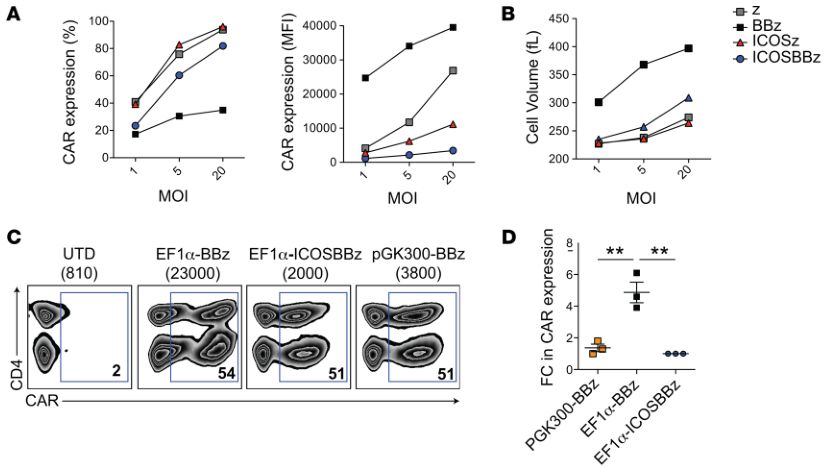
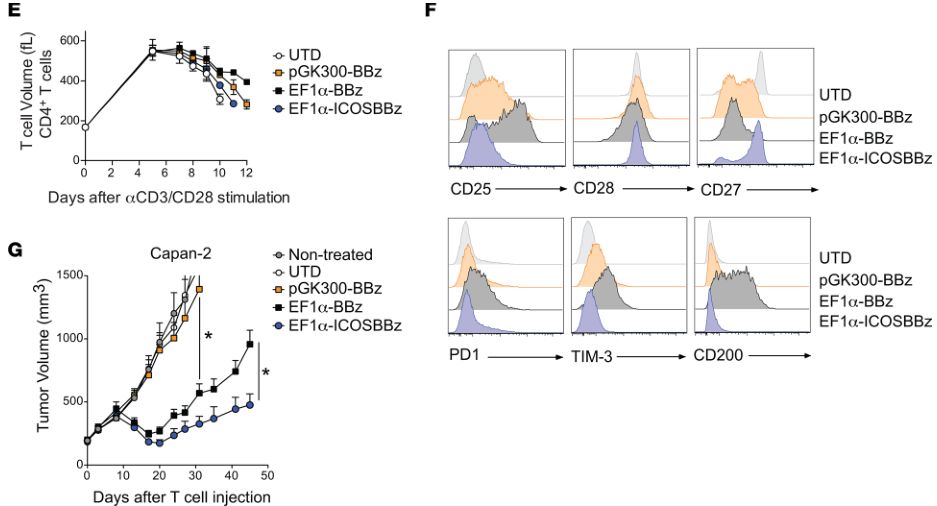
细胞表面CAR的表达水平影响抗肿瘤作用(图片来源 JCI)
经过分析,研究人员发现ICOSBBz-CAR在T细胞表面的表达水平比ICOS-CAR或BBz-CAR都要低。如果CAR表达过高,会导致T细胞处于持续激活状态,进而更容易导致T细胞的耗竭。而T细胞耗竭正是影响CAR-T细胞持久性和抗癌活性的一个重要因素。
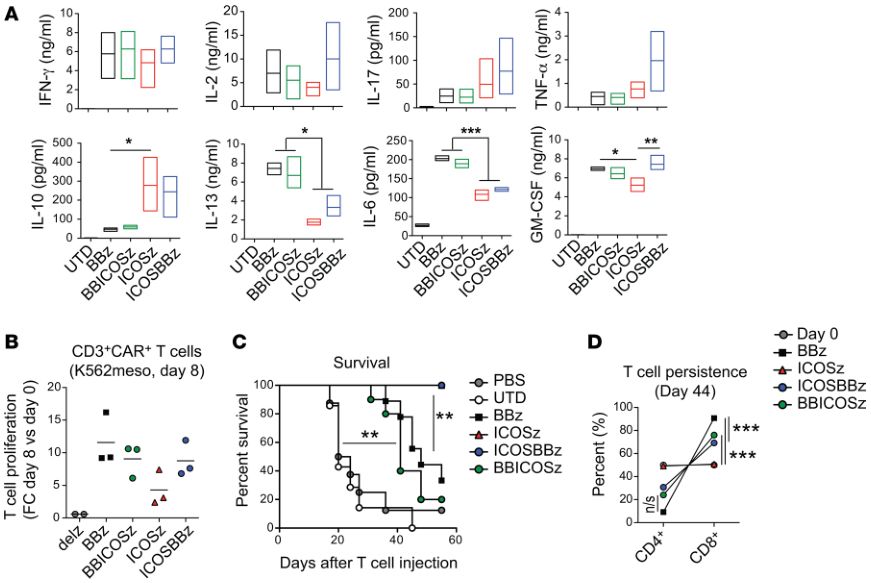
只有当ICOS靠近细胞膜时,ICOSBBz增强的体内抗癌作用才能被观察到(图片来源 JCI)
此外,ICOSBBz-CAR在T细胞表面的表达还导致了细胞表达的细胞因子图谱发生重大改变,而这些因素都可能是表达ICOSBBz-CAR的T细胞具有更强的肿瘤杀伤能力的原因。并且ICOSBBz-CAR分子设计的每一个细节对T细胞的抗癌效果都有影响,如果让4-1BB共刺激蛋白域更接近TM(跨膜结构域),CAR的抗肿瘤能力会下降。而当ICOS靠近细胞膜并与ICOS TM(跨膜结构域)连接时,CAR的抗肿瘤能力会增强。
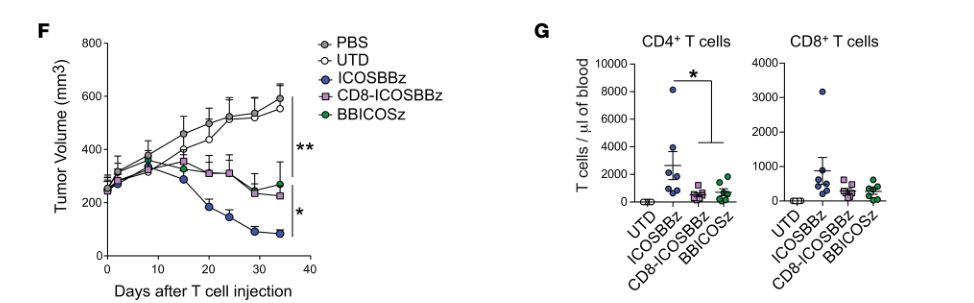
ICOS跨膜结构域对于改善抗肿瘤效果和增加持续性是必需的(图片来源 JCI)
综上所述,这些研究结果提供了一种新的策略来优化CAR CD4 +和CD8 + T细胞的扩增和持久能力,将促进新一代的CAR-T在实体瘤患者的治疗中取得更优异的抗肿瘤效果。