
PD1/PD-L1药物是当前备受瞩目的一类新肿瘤疗法药物,也是目前免疫治疗中的主力军。十三五规划中的《医药工业发展规划指南》中,明确印发了“重点开发肿瘤免疫治疗药物PD-1/PD-L1”。

苏州康宁杰瑞开发的PD-L1单域抗体药物KN035,在去年获得CFDA和FDA的临床批准,并有着一系列“头衔”,比如第一个皮下注射的PD-1/PD-L1药物,第一个在美国申请IND的国内新药等。此类蛋白质药物有无数种方法进行鉴定,而通过蛋白质晶体的结构学分析才是揭示蛋白质最本质的信息。作为一种万众瞩目的药物,当然最好有它的结构学分析的信息。
今天就让陈老湿通过康宁杰瑞和上海交通大学药学院共同发布的《Structural basis of a novel PD-L1 nanobody for immune checkpoint blockade》这篇文章给大家介绍一下纳米抗体KN035在结构学方面的研究(KN035与PD-L1复合物的解析度1.7Å水平)。
总体结构学分析:
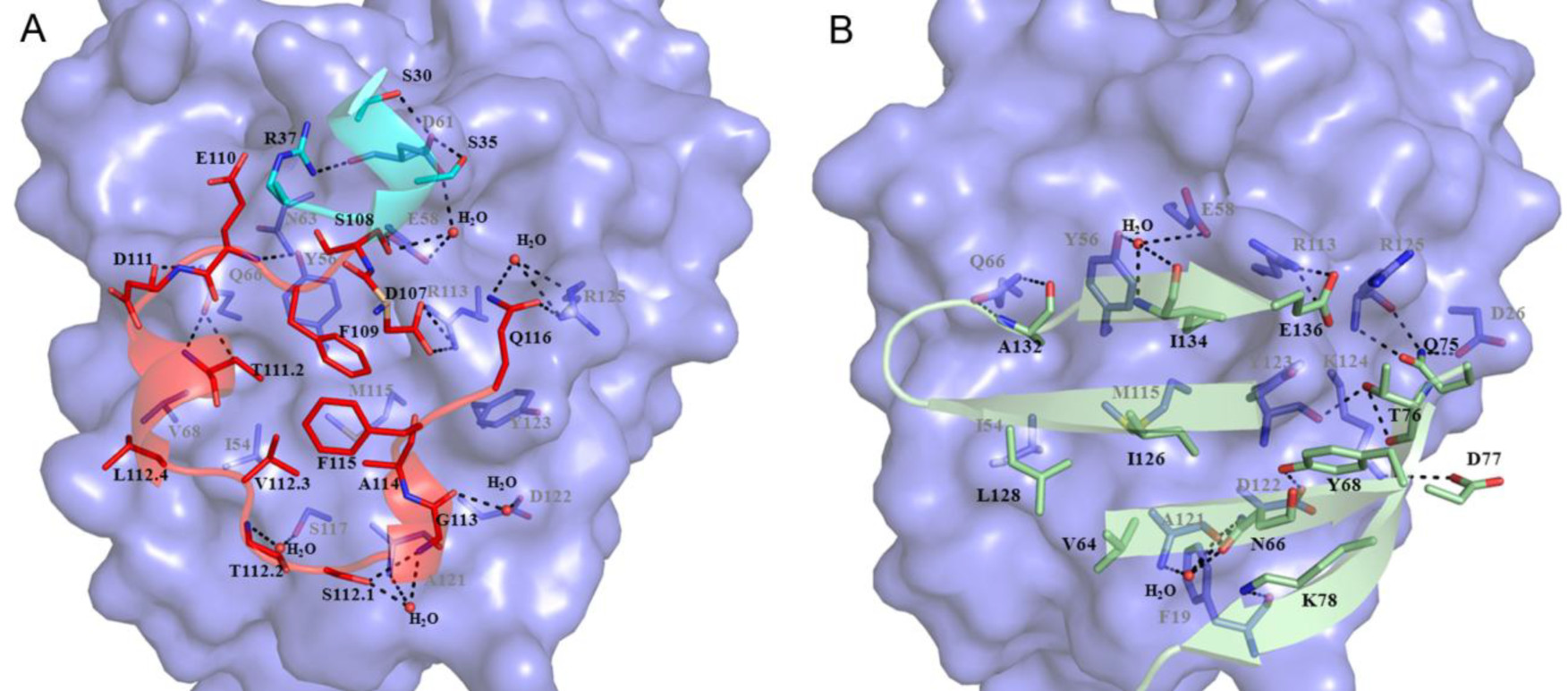
下图展示了KN035和PD-L1的晶体复合物。可见,KN035的CDR1和CDR3以1:1的比例与PD-L1的IgV区域结合。KN035有一个固定的二硫键和B,F短链接(SS1:Cys23-–Cys104)。KN035的CDR1环形成短α螺旋,然而CDR3环独自形成一个短α螺旋和短310螺旋,而在其他的纳米抗体中我们观察不到这些,这些都是KN035独特的结构。
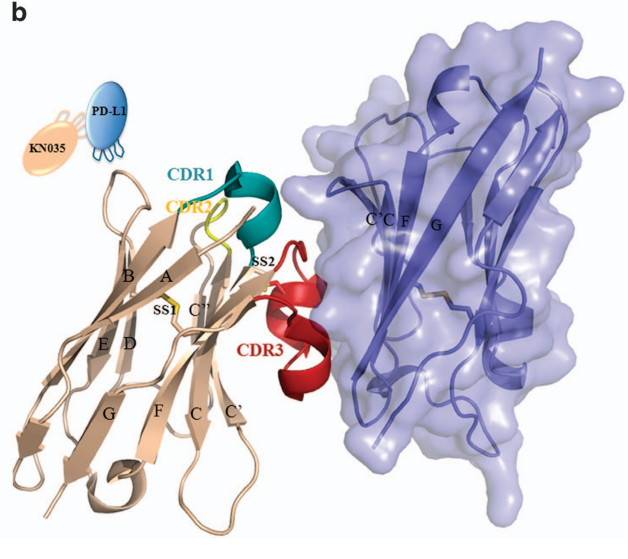
KN035/PD-L1复合物总体结构
KN035与PD-L1的IgV区域结合,KN035的CDR1 and CDR3聚集在由CC’FG链组成的PD-L1表面,同时覆盖了1.245Å2表面区域。与这里单个的PD-L1结构和与KN035形成复合物PD-L1的结构相比,KN035的结合导致PD-L1主链的微小的构象变化,链接PD-L1的C和C’端的环弯曲了2Å,从而形成了KN035与PDL1的复合物,同时PD-L1的侧链也发生了细微的改变。总之,从这些结构学分析,结合区域是非常牢固的。
KN035的Phe 109芳环垂直地与PD-L1的Tyr56叠加,我们可以明显观察到π–π键叠加的相互作用。在KN035的CDR3和PD-L1的Ile54、Val68、Met115的作用中,这种叠加作用通过其他的疏水残基(Leu112.4,Val112.3,Ala114和Phe115)进一步稳定结构。突变研究和随后的亲和力实验表明,在PD-L1中,将Tyr56突变为Ala,其与KN035的亲和降低了4400倍,将Ile54突变为Ala,亲和力降低了80倍。
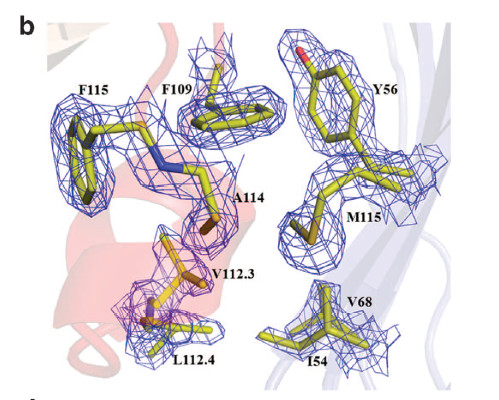
KN035/PD-L1复合物部分清晰电子密度图
除此之外,PD-L1上的E58,Q66,R113氨基酸残基也与KN035上对应的氨基酸残基形成各种化学键。
突变体亲和力检测结果
虽然结构数据证实了哪些氨基酸残基参与结合,但是并不知道哪些残基对结合最重要。这个时候就需要对这些残基突变掉,然后检测亲和力,如果亲和力掉得越多,说明这个氨基酸残基最重要。这时候BLI技术(生物膜干涉技术,请关注该微信号中的BLI小铺)就闪亮登场了,作者用康宁杰瑞的OCTET K2(基于BLI技术仪器的一个型号)分析了KN035与不同PD-L1突变体之间的亲和力。因为KN035为Fc融合蛋白,所以可以使用proA传感器固化KN035检测不同的PD-L1的突变体。
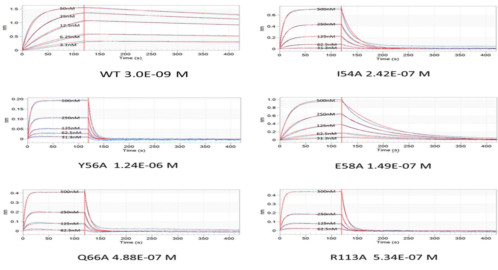
不同突变体的PD-L1与KN035的动力学检测结果
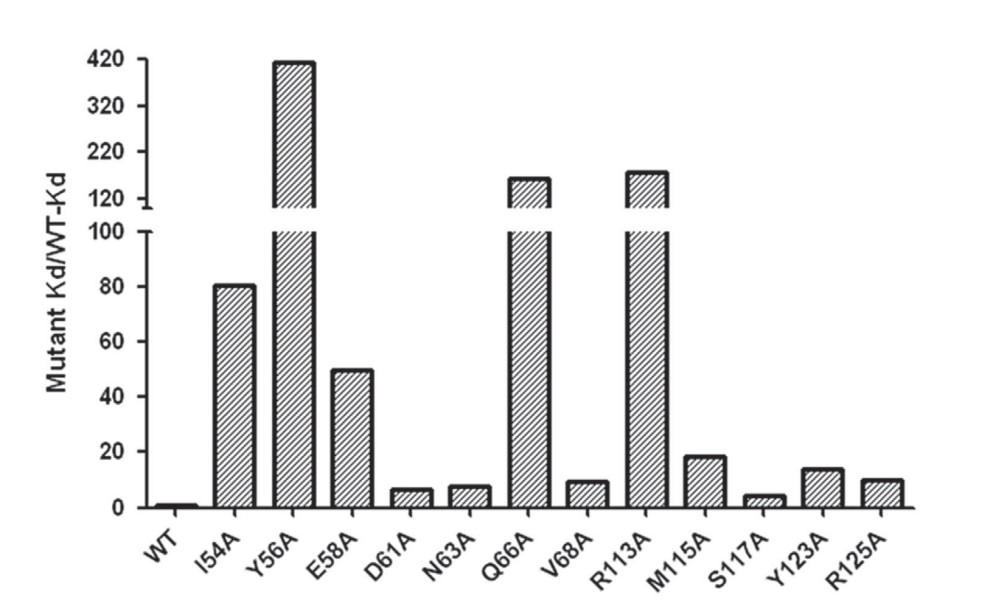
不同突变体的PD-L1与KN035的亲和力
可见,PD-L1上的I54,Y56,E58,Q66,R113氨基酸突变后,亲和力大大下降,说明这几个氨基酸残基对结合最重要,而其他参与相互作用的氨基酸残基突变后,亲和力也发生了不同程度的降低,这个结果与结构学分析的结果吻合。可见,BLI数据质量非常高,拟合也非常好。说明BLI技术对动力学的检测的能力是非常强的。BLI技术检测所有这些样品所有亲和力只需要花费半天的时间,并且只消耗少量样品。
PD-L1和KN035与PD1的结合位点比较
从PD1/PDL1以及KN035/PDL1的复合物结合位点分析发现,KN035和PDL1与PD1的结合结合位点是一致的,所以KN035可以很好的抑制PD1与PDL1的结合。但是PDL1与PD1的结合面积不小,为什么PD1与PDL1的亲和力仅为uM级别,与KN035的亲和力弱了三个数量级呢?作者把结构学上发现的PDL1上参与结合的氨基酸残基突变掉后,与PD1的亲和力并没有改变,但是与KN035的亲和力改变了很多。
比如Arg113就是一个例子。PDL1的Arg113可以和PD1的Glu136形成一个盐桥,就像KN035的Asp107。但是PD1的这个盐桥相对来说比较弱,而且PDL1的Arg113和PD1的Gly136的侧链并不在同一平面。PDL1的Glu58对KN035亲和力非常重要,但是突变Glu58使得PD1的结合没有明显变化。另外,参与形成疏水键的PDL1的Tyr56也有类似情况。而只有PDL1的M115的突变对PD1的亲和力影响比较大。
这些情况说明PDL1的多个氨基酸残基都对维持KN035的亲和力非常重要,间接说明了这些氨基酸残基都增加了KN035的结合。做出这些判断都是通过检测亲和力来获得的,可见亲和力的检测是结构学必需的一个手段。
PDL1与KN035的结合位点分析 PD1与PDL1的结合位点分析
从这篇文献看出,结构学的亲和力研究需要检测很多突变体,对通量有比较高的需求。而BLI技术不仅可以在短时间内获得良好的结果,而且耗用样品少,耗用样品少。采用非标记技术,可以获得更可靠的结果。本次试验所用的proA传感器可以再生很多次,成本低廉。
可见康宁杰瑞公司使用的OCTET不仅用来检测KN035的亲和力,也检测FcRn等表征项目,当然BLI所做出来的这些数据都出现在了CFDA和FDA的临床申报中,并顺利的通过了临床审批,当然也打了那些说BLI技术不会被CFDA和FDA接受的人的脸!