
4月6日,Incyte宣布其IDO抑制剂epacadostat+Keytruda组合疗法的Ⅲ期临床试验ECHO-301失败。这一备受业内期待、有望揭示IDO抑制剂可行性的关键研究失利,让近年来高歌猛进的IDO抑制剂开发突然陷入了困境。
当天,Incyte和主攻IDO开发的NewLink股票即分别下跌22%和42%。更有一批已进入临床晚期的试验纷纷被叫停,Incyte和NewLink暂停了部分IDO抑制剂的联合研究,BMS随后也宣布因“商业计划变动”,暂停其IDO抑制剂BMS-986205两项联合Opdivo的Ⅲ期临床。
ECHO-301失败究竟会给IDO抑制剂领域乃至肿瘤免疫联合治疗带来怎样的影响,显然是业界最关注的问题。究竟是暂时的蛰伏还是溃败的前兆,会不会峰回路转呢?现在还不宜也无法做出判断。而重新回顾、梳理,思考该领域存在的问题和挑战,是面临挫败和教训时最为理性有效的方案。
临床设计之过?
事实上,epacadostat联合Keytruda的Ⅰ/Ⅱ期临床ECHO-202结果还算不错。ECHO-202一共入组了65名黑色素瘤患者,2017年9月公布的数据显示,63名被试者中,疾病总缓解率(OR)为56%,疾病控制率(DCR)为71%,中位无进展生存期(mPFS)为12.4个月。Keynote-006试验显示,Keytruda单独治疗黑色素瘤的PFS为5.6个月。而到了ECHO-301,联合疗法相较单用Keytruda,却未能改善PFS(HR为1.0)。
早期临床结果积极,Ⅲ期滑铁卢在制药圈中其实并不鲜见,ECHO-301的失败在业内一些专家看来也并非意外。一位业内专家透露,至少在公布结果的6~9个月之前,业内不少知名博客中就已经出现质疑产品的声音。
临床设计可能是目前被讨论最多的问题之一。
ECHO-202与ECHO-301的临床设计不同。ECHO-202为单臂研究,纳入很多不同瘤种,包括黑色素瘤、结直肠癌、子宫内膜癌、头颈癌、肝细胞癌、胃癌、非小细胞肺癌、淋巴瘤、肾细胞癌、卵巢癌和乳腺癌等12个。ECHO-301为随机双盲研究,针对700多位无法手术的晚期恶性黑色素瘤患者,按PD-L1表达和BRAF变异分层,比较联合疗法与Keytruda单药的疗效。
由于ECHO-202是单臂研究,未设立对照组,一些业内人士认为这会导致患者选择的偏差,从而影响临床Ⅲ期的设计与最终结果。然而,这样的设计在IDO抑制剂开发中是非常普遍的问题,大多数IDO联合PD-1/PD-L1开展的早期临床试验为单臂研究,没有对照组。美国安德森癌症中心的生物统计学家Donald Berry在接受BioCentury访谈时曾表示,设立借鉴其他临床试验数据的小型对照组能够提供更多可靠的数据,有利于药企Ⅲ期临床的决策。
这位推崇适应性设计临床试验的专家认为,利用新颖的试验设计,可以节约成本、保留患者、更好预测后期临床的成功几率。更进一步讲,Incyte如果想要设计更为高效率的联合治疗方案,在Ⅰ期体现出早期疗效信号时,采用无缝对接的临床设计,扩大相应适应症的入组队列,比启动新的Ⅱ期或Ⅲ期研究更好。这样的方式可以更好判断试验中数据和发现的可靠性。
默沙东的Keytruda就是这方面的成功例子,Keytruda单药二线治疗转移性黑色素瘤和非小细胞肺癌,在Ⅰ期中表现出强而持久的应答后,默沙东应用扩展队列迅速在这两个适应症中招募更多患者,最后在进入临床3年后,即依靠173位黑色素瘤患者数据获批上市。
另外,ECHO-202与ECHO-301针对的均是一线治疗。2017 年初,默沙东和 Incyte 宣布同时启动肺癌、膀胱癌、头颈癌和肾癌的多个Ⅲ期临床,大部分针对一线用药,没有PD-L1水平限制。定位一线、不强制PD-L1高表达、又同时开展多个Ⅲ期临床,本身意味着成功后更高的回报,但也代表了更高风险。
而在肿瘤领域一位专家看来,IDO的另一个重大失误是,没有机制明晰的biomarker进行患者的筛选。因为不大可能有适用于所有肿瘤的机制,所以可预测性的biomarker至关重要。现在业界还并不了解IDO适用于哪类人群。
此前,nivolumab联用IDO的初步临床试验结果倾向,PD-L1的高表达可以筛选出响应率高的患者群。但这是否是IDO行之有效的biomarker,还有待进一步研究。
至于Incyte仅依靠小规模早期临床积极数据即推入大规模Ⅲ期临床是否操之过急,业内对此看法也是见仁见智。
一位来自跨国企业的专家表示,从商业的角度来讲,IO的竞争已非常激烈,想要占据先机,默沙东或者BMS必然要赌一下。有声音认为投资者比较不理性,但是资本市场在这个案例中追求的是效率,追求的是尽快获得数据。临床失败这样大的不良事件导致Incyte的股票下降了20%多,可以想见,如果结果积极,会有远大得多的获益。
国内创新药企的一位高管则认为,迅速推动产品进入Ⅲ期是默沙东防御性的策略,因为竞争对手BMS的联合方案Opdivo+Yervoy在多个适应症中表现出不错的潜力,比如在Checkmate-067中,该联合方案取得11.7个月的mPFS。目前,Opdivo+Yervoy是唯一上市的IO/IO联合方案,用于黑色素瘤与肾细胞癌(最近获批)。相较而言,与epacadostat的联合只是默沙东Keytruda联合开发方案中不确定性较小的选择。有资源并且愿意用资源赌一把的大公司,有资本为了成功同时开展很多临床研究。
机理隐忧
之所以这项临床失败激起业界如此大的反响,不仅因为epacadostat是IDO领域进展最快的产品,其研究的成败为揭示通路可行性的重要一役;另一方面,这一挫败很可能戳到了业界本来就存在的诸多疑虑。
不少投资者和药企参与者对IDO的作用其实有所保留,最重要的一个原因在于IDO抑制剂单药无效,其数据和临床表现也一直比较不稳定,这让人担心靶点和通路本身即存在问题。
IDO是人体色氨酸代谢的限制酶,广泛存在于肿瘤的代谢途径。IDO酶过表达,会导致色氨酸耗竭,色氨酸是保持T细胞活化的重要营养物质,其产生的代谢产品犬尿氨酸也会抑制免疫细胞的活性。目前药企研发的IDO抑制剂,主要通过抑制IDO1酶的活性,解除免疫抑制来对抗肿瘤。
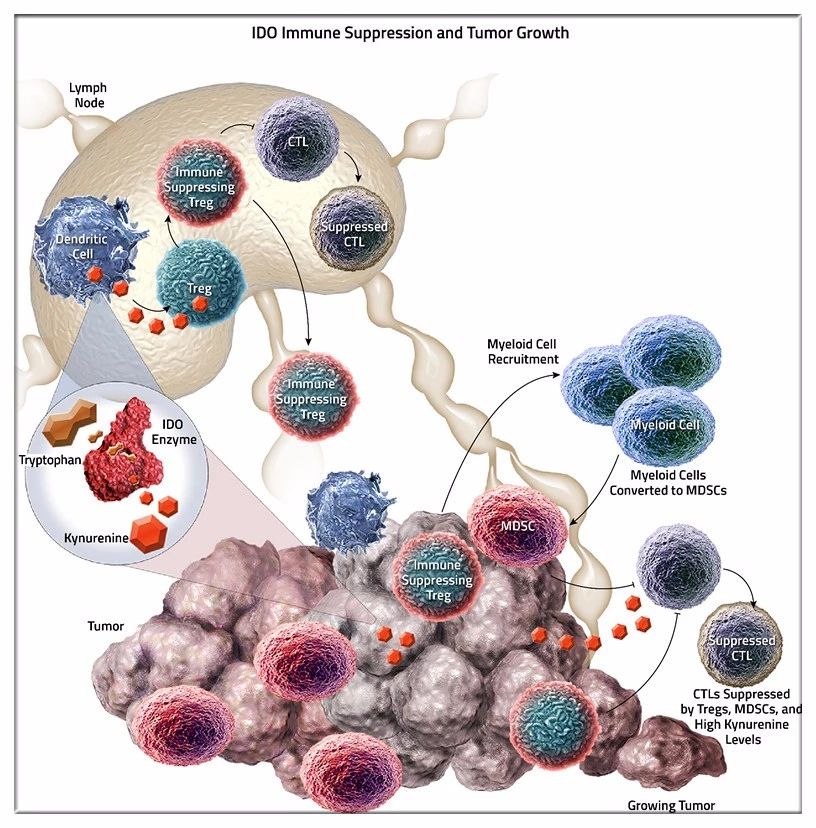
IDO抑制剂作用机理 来源 | NewLink官网
不过,业界对于IDO家族作用机理的了解依然非常有限,尤其在应用于人体之后。且IDO仅仅是肿瘤免疫逃逸的一条路径,单纯抑制IDO解除免疫抑制的效果也可能非常有限。此前,epacadostat单药在一项纳入52名患者、针对实体瘤的Ⅰ期临床的结果恰是证明,在该研究中,未见完全缓解和部分缓解的病例。
这样的临床表现必然导致业界人士对IDO通路有效性存在忧虑,也成为IDO以联合作为主要方向的重要原因之一。2013 年,肿瘤免疫学家James Allison发现CTLA4抑制剂与IDO1抑制剂联用能够有效缩小黑色素瘤小鼠的肿瘤,使其生存期延长。IDO 抑制剂与PD-1/PD-L1单抗联用也会产生类似的抗肿瘤作用。通过组合疗法提高PD-1抗体应答率当时已是业内的共识。因此,以Incyte和Newlink为主的IDO抑制剂开发企业基本都转向联合疗法开发。
但是,联合疗法开发实际非常复杂,尤其在肿瘤免疫这一机制本身就非常复杂的领域,联合治疗想要发挥出协同的效应,不仅意味着药物作用机理、机制的正确选择,剂量、应用顺序等因素均会产生不可忽视的影响。哪些机理联合是最为理想的方案,怎样才能发挥出协同而不是叠加效应既难以判断又很考验企业的能力。由此看来,联合治疗有很大不确定性,需要回归临床数据的验证。
IDO抑制剂联合PD-1/PD-L1抗体从机理角度出发,均是解除免疫抑制,如果没有活化的T细胞,是不是能够发挥足够的抗肿瘤活性,这一联合策略是否可行,从现有的临床结果来看,显然还未达到预期。
有研究表明,不仅肿瘤细胞中表达IDO酶,肿瘤微环境中的免疫抑制细胞同样会表达IDO。这也说明IDO抑制剂可以通过作用肿瘤微环境发挥作用。而对于机制复杂的肿瘤免疫治疗,解除抑制、激励免疫细胞活性、研究微环境作用多点入手有可能带来更好的响应率和治疗效果。所以,有声音认为,相比于直接放弃资产或仅专注解除免疫抑制的作用,把IDO视作“cancer marker”可能是更有效的开发方案。
现在可以肯定的是,企业依然需要开展进一步的深入研究,寻求IDO抑制剂本身机理和优化联合方案的答案。更多的研究意味着更多的发现,也意味着更多选择。
“起死回生”的契机
业界对这个通路和其产品存在的这些将信将疑,可以说侧面解释了为何一遇到挫折,公司便纷纷暂停了一大部分相关项目。
就像此前赛诺菲的PARP抑制剂失败后,大公司纷纷离场,只有阿斯利康坚持留在这个领域。美国大公司也存在这样的跟风现象。而之后,BRCA突变这一biomarker的发现拯救了整个PARP抑制剂开发领域,所以在IDO抑制剂开发中,通过改善临床设计、适应症选择等手段,依然存在“起死回生”的机会。