
免疫检查点疗法出现彻底改变了癌症治疗方法。针对PD-1及其主要配体PD-L1的单克隆抗体已证明在多种癌症类型中具有抗肿瘤作用。然而,针对PD-1/PD-L1的疗法并不完全尽如人意:一些患者经历快速和持久的肿瘤消退,但大多数患者获得很小或没有明显的效果。为了增加对免疫疗法有反应的患者比例,医生和研究人员正在研究一系列令人眼花缭乱的新免疫调节靶点和治疗策略。其中一种很有希望的策略是对免疫刺激受体激动作用以诱导免疫细胞活化。这种“共刺激”策略为临床开发中的多种药剂提供了机制基础,包括靶向OX40,CD27,CD40,GITR和4-1BB的抗体。4-1BB,一种表面糖蛋白和肿瘤坏死因子受体(TNFR)超家族的成员,作为治疗靶点具有独特的吸引力。在这里,小编着重介绍 4-1BB激动的基本原理,最近进入临床的4-1BB单克隆抗体(mAbs)的临床试验结果和下一代4-1BB靶向治疗策略。
4-1BB 简介
4-1BB(CD137)最初于1989年鉴定,最初被描述为由活化的细胞毒细胞和辅助性T淋巴细胞表达的诱导型基因。功能表征显示4-1BB与其主要配体4-1BBL相互作用正调节T细胞免疫。研究发现几种靶向4-1BB受体的抗体在体外可以为T细胞提供共刺激信号,复制了天然4-1BBL提供的激动作用。在移植抗宿主病的小鼠模型中,激动性4-1BB单克隆抗体的使用加剧了细胞毒性CD8+ T细胞介导的组织损伤并加速了心脏和皮肤同种异体移植物的排斥。T细胞上的4-1BB连接触发信号级联,其导致抗细胞凋亡分子的上调,细胞因子分泌和细胞效应功能增强。在功能失调的T细胞中,4-1BB连接显示出恢复其效应功能的能力。4-1BB在增强T细胞细胞毒性中的作用为4-1BB单克隆抗体的开发提供了科学依据。
最初认为4-1BB表达限于活化的T细胞,但后期研究发现4-1BB在整个造血和非造血细胞室中广泛表达。例如DC,活化的单核细胞和NK细胞,嗜中性粒细胞,嗜酸性粒细胞和肥大细胞。在NK细胞上,4-1BB信号传导可以增加抗体依赖性细胞介导的细胞毒性(ADCC)。作为免疫活性的多功能调节剂(图1),4-1BB已成为癌症免疫疗法中有待探索的极具希望的靶标。
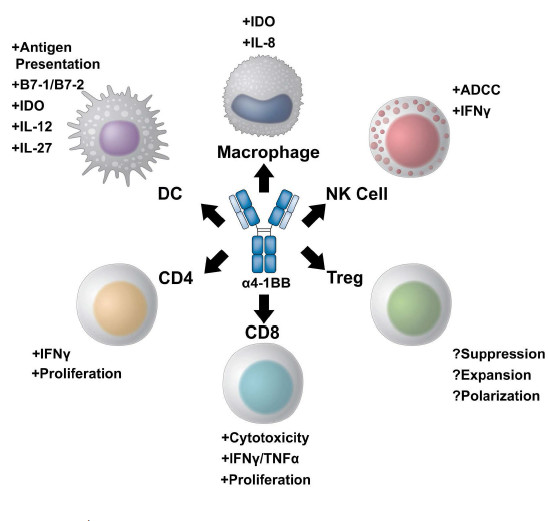
图1.4-1BB mAb多重免疫调节作用
Urelumab
Urelumab(BMS-663513)是一种全人的IgG4 mAb,是第一个进入临床试验的抗4-1BB治疗药物。 Urelumab不会阻断4-1BB与其配体的相互作用。最初的临床结果发表于2008年.尽管有令人鼓舞的疗效,但Phase1和Phase2阶段的数据显示肝脏毒性似乎与靶标和剂量有关,并阻碍了其临床开发。2012年其重新开始并迅速扩展至rituximab, cetuximab, elotuzumab和nivolumab组合测试临床试验(NCT01471210,NCT01775631,NCT02110082,NCT02252263,NCT02253992)。最近更新了urelumab上作为单一疗法并与nivolumab联合使用的临床数据。再次,在0.3 mg/kg剂量下出现肝脏毒性信号,导致每个患者平均剂量为8 mg;8mg剂量的药代动力学曲线与0.1mg/kg剂量相当,但减少的剂量改善了肝毒性。更为重要的是,urelumab和nivolumab组合显示出一定的耐受性,在药物组合组治疗的患者中仅有16%经历了3-4级治疗相关的不良事件(TRAE)。但低剂量urelumab单药治疗效果以及与nivolumab联合治疗效果目前的临床数据并不理想。尽管在耐受剂量下urelumab的临床活性有限,但我们仍然对激动剂抗-4-1BB mAb的发展充满期待。比如最近在转移性黑素瘤患者中使用urelumab的数据表明PD-L1阳性和PD-L1阴性肿瘤患者之间的反应率相似,表明urelumab可能扩大对抗PD-1 mAbs有反应的患者库;在人源化小鼠模型中使用urelumab的实验证实了urelumab的效力和免疫调节能力;在植入患者来源的胃癌并随后来自同一患者的PBMC的小鼠模型试验中,用urelumab和nivolumab的组合治疗减缓了肿瘤生长并增加了活化的人T细胞的数量。令人信服的临床前结果和不理想临床试验的脱节可能是由于给药方案不充分所致。避免肝脏毒性所需的8mg扁平剂量可能太低,无法达到足够的目标占用率和治疗活性。因此如何避免肝毒性并在TME中达到适当的药物暴露水平以达到治疗疗效值得研究。
Utomilumab
Utomilumab(PF-05082566)是人源化IgG2单克隆抗体,其激活4-1BB,同时阻断与内源性4-1BBL的结合。2014年报告了使用utomilumab的初步临床数据,并揭示了utomilumab相对于urelumab可能具有更高的安全性。utomilumab卓越的安全性使联合免疫治疗试验成为可能。目前,utomilumab正与avelumab(抗PD-L1 mAb)(NCT02951156)以及与avelumab和OX40 mAb(NCT02554812)的首批三药联合免疫治疗方案正在进行临床试验。utomilumab是一种比urelumab更弱的激动剂。相比之下,utomilumab引起较少的4-1BB信号传导和较少的NF-kB诱导。utomilumab和urelumab mAb之间的已知差异包括:内在激动活性,免疫球蛋白亚类,Fc受体结合谱,4-1BB上的靶向表位和4-1BBL阻断能力。但两者的差异仍有许多基本的生化和内在机制问题值得研究。未来的临床试验将有助于阐明这些特性对抗4-1BB mAb活性的影响,并确定哪种激动水平治疗效果最佳。
安全性
最近对使用urelumab治疗的患者进行了全面的安全性分析,证实了转氨酶和urelumab剂量之间的强烈关联。鉴于肝功能异常和肝脏TRAEs,研究人员已经进行了广泛的研究以了解4-1BB肝脏毒性的机制基础。在BALB / c和C57BL / 6小鼠中,用4-1BB mAb后出现了单核细胞炎症,主要由肝脏门静脉区域的浸润性T细胞组成.而这种毒性为T细胞和4-1BB依赖性并且没有出现在Rag-/-或4-1BB-/-小鼠中。肝脏浸润性T细胞不是寡克隆T细胞,并且研究表明相关的自身免疫反应不是由自身抗原驱动,而是由非特异性CD8+ T细胞激活导致。 CD8+ T细胞耗竭消除了肝脏的病理表征,以及中和了TNF或IFN-g的作用。后来的研究证实4-1BB在未免疫小鼠肝脏和骨髓中约10%的CD8+ CD44 T细胞上表达,这可能解释了肝脏T细胞对抗4-1BB治疗的反应。其他研究如在乙型肝炎病毒转基因小鼠中,肝脏毒性是由非特异性记忆CD8+ T细胞以MHC-I非依赖性方式诱导的。目前正在进行的研究主要集中在研究骨髓室,主要是IL-27和Foxp3+调节性T的介导的肝毒性。关于4-1BB介导的抗肿瘤免疫与肝毒性的不同模式的进一步机制研究为开发具有良好副作用的新型4-1BB激动剂铺平了道路。目前主要挑战是鉴定导致肝脏炎症的关键细胞事件,并制定解毒性和抗肿瘤功效的策略。
鉴于临床前和已经进入临床的4-1BB mAb的配体阻断效应的差异,值得考虑阻断4-1BBL结合对毒性的影响。在试验研究中,Shuford等人测试了一系列抗鼠4-1BB抗体,发现4-1BB配体阻断与体外T细胞刺激无关。有趣的是,4-1BB mAb如3H3和2A对4-1BB配体结合具有相反的作用,但表现出相似的肝脏毒性特征。因此,在小鼠系统中,似乎4-1BB配体参与与否不能决定4-1BB介导的毒性或抗肿瘤功效。目前进行的研究希望确定人4-1BBL对肝毒性的重要性以及其他潜在的4-1BB配体在驱动信号传导中的作用。已经有研究提出细胞外基质和Galectin-9都是4-1BB结合配体。因此进一步研究其他配体 - 受体相互作用对4-1BB信号传导尤为重要。
考虑到临床试验相关的时间,成本和患者的费用,使用可以更准确地建模和预测免疫相关副作用的临床前系统将会加速鉴定限制性毒性和最佳的治疗组合。其中一个重要贡献是转基因小鼠,其中模型便有人免疫调节受体及其配体的基因被引入鼠对应的位点(敲入[KI]小鼠)。这些模型允许研究人员在功能性免疫系统的背景下研究治疗效果,以及可以促进更准确的进行免疫相关毒性评估。人类细胞毒性T淋巴细胞抗原4(CTLA-4)基因KI小鼠的发展说明了这个策略的有效性。在CTLA-4 KI小鼠中,用CTLA-4 mAb处理出现了与抗CTLA-4 mAb ipilimumab治疗的患者中观察到的相同的自身免疫毒性。具有人Fc受体的KI小鼠提供了研究具有不同人IgG亚型的治疗性抗体机制的系统。尽管IgG4和IgG2均诱导相似但有限的ADCC,但仍不清楚urelumab和utomilumab之间亚型的差异是否有助于功效或安全性。除了产生更强大的临床前模型外,预测免疫相关的副作用还需要更好地了解控制人类免疫力的基础遗传,表观遗传和环境因素。目前敲入人4-1BB的KI mice用于研究4-1BB mAb的功效和安全性的公司有CrownBio和Biocytogen。
下一代策略
目前正在进行多项努力以开发新治疗策略,以使4-1BB激动作用最大化同时使4-1BB诱导的毒性最小化。目前三种富集到TME中的4-1BB激动剂活性的策略最近已发展到临床开发:瘤内(IT)施用mAb,引入肿瘤抗原或肿瘤基质成分的4-1BB的双特异性抗体(bsAb),以及通过肿瘤特异性蛋白酶将“masked”的抗体变为“unmasked” 抗体。
4-1BB激动剂为IT mAb治疗提供了理想的候选药物。由于IT给药最大化使4-1BB激动剂暴露于TME中的淋巴细胞,因此IT给药可以减轻用urelumab观察到的剂量依赖的肝毒性作用。此外,抗体扩散到肿瘤外可能激活驻留在下游的淋巴细胞,这可能带来额外的治疗益处。
目前多个4-1BB靶向的双特异性抗体处于临床前或早期临床开发阶段,并且已经证明了有希望的早期数据。具体请参考之前小编的文章:BsAbPK tumor: 如果“爱”请深“爱”;若不“爱”,别走开。该策略的优点是双重的:系统毒性受到限制,因为激活将局限于表达靶抗原的组织,并且肿瘤介导的4-1BB crosslinking 作用可以有效的发挥激动作用(图2)。
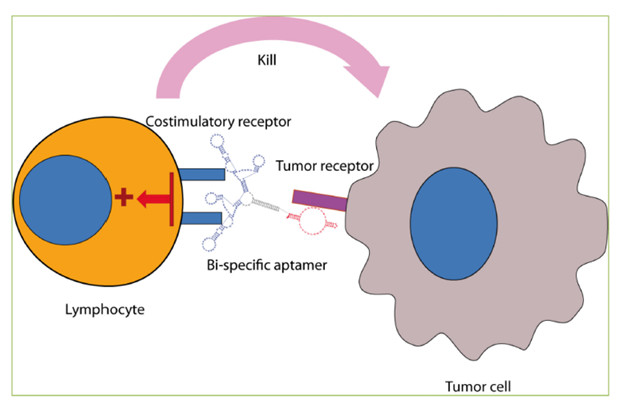
图2. 肿瘤靶向的双特异性抗体促进肿瘤靶细胞附近的T淋巴细胞活化
对肿瘤特异性蛋白酶的研究以及蛋白质工程的新技术的出现为开发对肿瘤组织具有选择性免疫治疗mAb创造了令人兴奋的机会。癌症的标志是TME和周围组织中的蛋白水解活性增加。 TME内蛋白水解活性的增加提供了开发蛋白水解活化抗体的机会。一种这样的策略为表达一种含有一段掩蔽抗体结合肽序列的抗体。掩蔽序列与mAb连接并可以在TME内被肿瘤相关蛋白酶如matriptase,尿激酶纤溶酶原激活物或半胱氨酸蛋白酶legumain切割,然后暴露其抗原结合位点,使得抗体发挥活性。已有使用PD-1和PD-L1 mAb的临床前数据证明该策略的有效性。最近,掩蔽版的ipilimumab相对于标准ipilimumab表现出减少的外周T细胞活化的作用. 在使用10mg / kg剂量的食蟹猴中,掩蔽版的ipilimumab没有使Ki-67+ CD4+或CD8+ T细胞增加至用相同剂量的标准ipilimumab观察到的水平。类似的方法可用于富集TME中4-1BB mAb的暴露并避免肝毒性因而成为一种很有吸引力的策略。
小编总结
现有的实验和临床数据都明确支持靶向4-1BB mAb 用于癌症免疫疗法的治疗潜力。 4-1BB在T细胞活化,持久性和记忆中起重要作用,并增加NK介导的ADCC。尽管4-1BB mAb(urelumab)可引起肝毒性,下一代4-1BB靶向策略如何将其抗肿瘤效力与其引起的肝脏毒性分离已展开大量的研究。目前已经出现了试图将4-1BB激动作用限制在肿瘤微环境中并使全身暴露最小化的多种治疗方法。未来的研究方向包括:4-1BB在Treg细胞和APCs生物学中的作用,4-1BB与其他免疫调节受体之间的功能性关联作用,以及4 -1BB激动剂的长期T细胞重编程作用和毒性机制的研究。随着我们对4-1BB生物学的理解的增加,我们开发有效的抗肿瘤疗法,并避免毒性以及开发预后和治疗性的生物标志物的能力也将提高。
参考文献
Cariad Chester, Miguel F. Sanmamed, Jun Wang, and Ignacio Melero, Immunotherapy targeting 4-1BB: mechanistic rationale, clinical results, and future strategies. Blood. 2018; 131:49-57(文章主要参考出处).
Vinay, Dass S., and Byoung S. Kwon. "Role of 4-1BB in immune responses." Seminars in immunology. Vol. 10. No. 6. Academic Press, 1998.
Chester, Cariad, Siddhant Ambulkar, and Holbrook E. Kohrt. "4-1BB agonism: adding the accelerator to cancer immunotherapy." Cancer Immunology, Immunotherapy 65.10 (2016): 1243-1248.
Segal, Neil H., et al. "Results from an integrated safety analysis of urelumab, an agonist anti-CD137 monoclonal antibody." Clinical Cancer Research 23.8 (2017): 1929-1936.
Hinner, Marlon J., et al. "Costimulatory T cell engagement via a novel bispecific anti-CD137/anti-HER2 protein." J Immunother Cancer 3.Suppl 2 (2015): 187.
Korman A. Next-generation anti-CTLA-4 antibodies. Paper presented at Annual Meeting ofthe American Association for Cancer Research. 1-5 April 2017.Washington, DC.