
糖基化修饰占到所有PTM(Post-translational Modification,翻译后修饰)的50%以上,对于治疗性蛋白药物(如重组蛋白药物、抗体药物),通过对免疫原性、半衰期、效应因子作用等的影响,对其安全性和有效性起到重要作用。从1986年批准第一个抗体药物OKT3至今,FDA已经批准了63个抗体药物和14个融合蛋白药物,以及其他很多蛋白药物(凝血因子、重组酶等),这些药物的应用极大改变了很多疾病的治疗格局。这其中多数药物带有糖基化修饰,本文重点介绍但不限于抗体药物的糖基化修饰。
糖基化修饰受细胞系、培养条件、纯化工艺等多因素的影响,学术界和工业界也发展了许多糖基化分析技术,对于糖基化过程和影响都有了更深的理解,也有助于更好的控制糖基化修饰的过程。
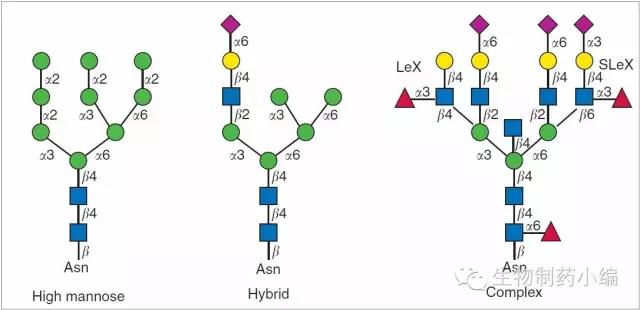
抗体药物的糖基化形式主要为N-糖基化,涉及的单糖主要:葡萄糖、半乳糖、甘露糖、N-乙酰葡糖胺、N-乙酰半乳糖胺、岩藻糖、唾液酸(NANA、NGNA)。

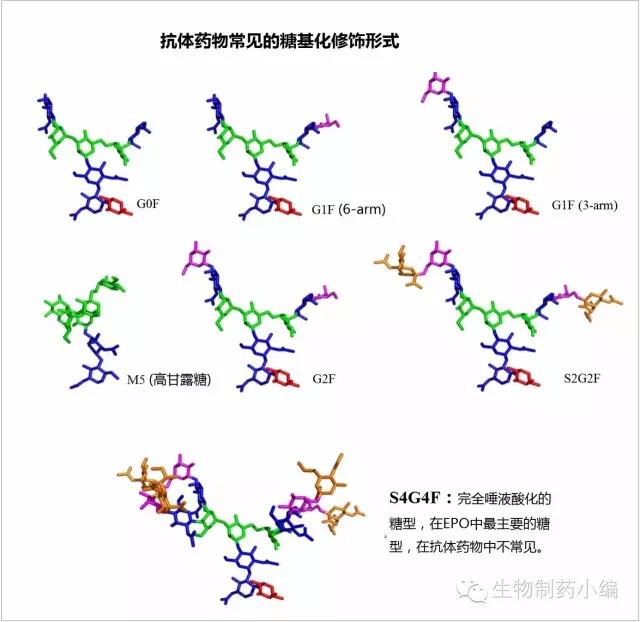
抗体药物的糖型主要包括如下几种。
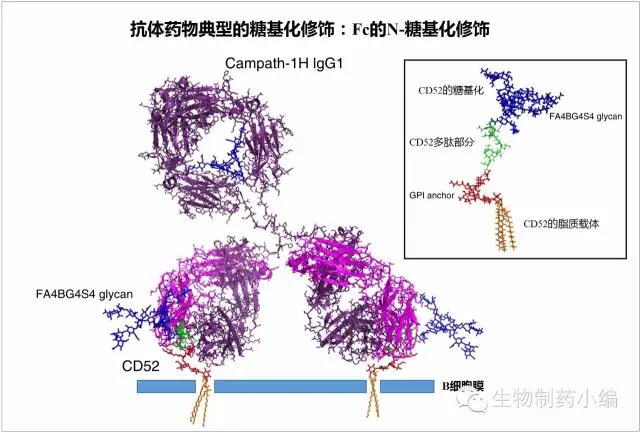
以CD52单抗阿仑单抗(商品名Campath)为例,其糖基化类型为经典的N-glycan,位点在IgG1的N297位。阿仑单抗的靶点为CD52,CD52的糖基化为完全唾液酸化的形式,从下图可见,CD52的糖基部分比CD52多肽还要更大一些。
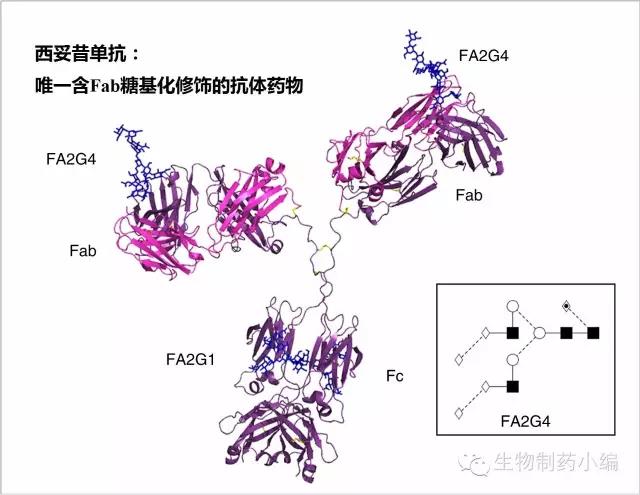
人体血浆IgG大约有20%包含Fab糖基化修饰,治疗性抗体中则一般选用单纯Fc N-糖基化修饰的结构。所有治疗性抗体中,仅有一个特例:西妥昔单抗。西妥昔单抗重链可变区含有一个N-糖基化位点。Fc的糖型为G1F,Fab的糖型为G4F(4个半乳糖)。
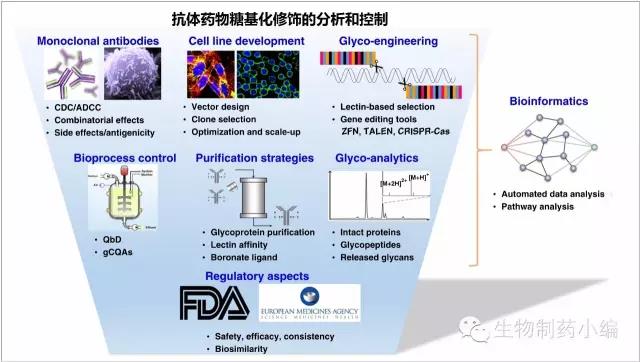
糖基化修饰的分析和控制面临诸多挑战,结构-功能关系(SAR)、细胞系筛选、糖基化改造、工艺控制、纯化策略、糖型分析、监管准入等都为抗体药物开发带来一些列挑战。
抗体药物糖基化对活性、半衰期等有明显影响,但仍有许多SAR关系待研究阐明。
表一几种常见糖型对抗体性质的影响
|
N-glycan 糖型 |
对抗体性质的影响 |
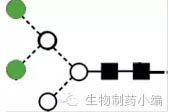 |
Man5:高甘露糖糖型,导致快速清除,半衰期缩短。 |
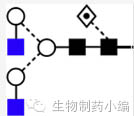 |
G0F:促进补体通路作用,加快清除速率。 |
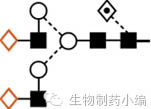 |
G2F:在孕妇和新生儿脐带中含量增加。 |
 |
唾液酸:唾液酸修饰对静脉注射免疫球蛋白的炎症作用影响明显。 |
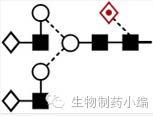 |
去岩藻糖基化:岩藻糖的去除导致ADCC活性明显增强。 |
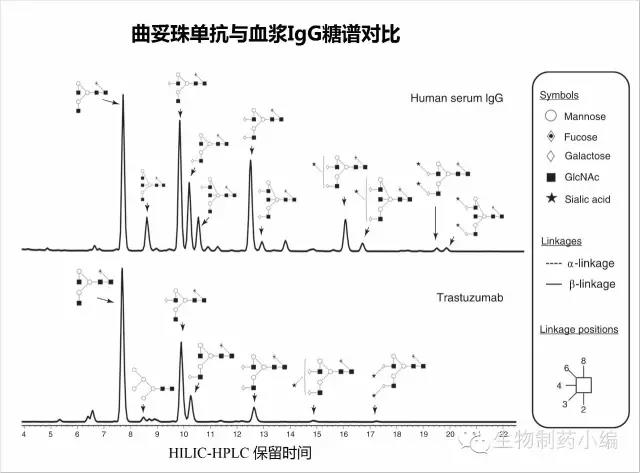
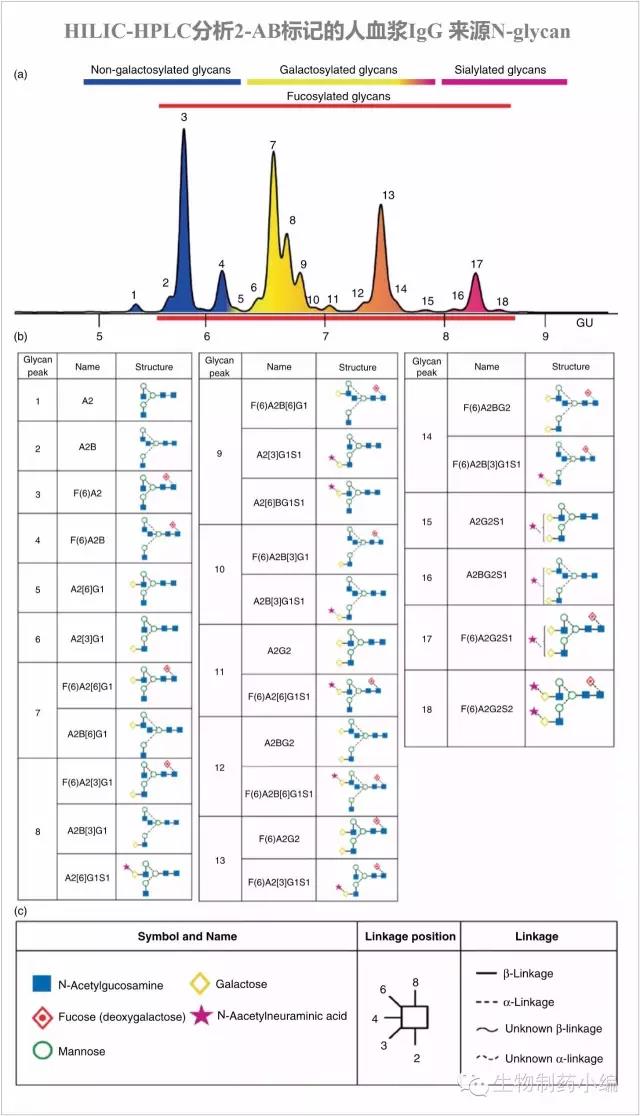
下图以曲妥珠单抗为例,与血浆IgG糖谱进行对比,可见曲妥珠单抗主要糖型为:G0F、G1F、G2F,其中G0F最多。区别有如下几点:曲妥珠单抗有少量高甘露糖组分Man5,而血浆IgG没有,主要由于其被甘露糖受体介导快速清除;血浆IgG唾液酸化组分明显更高,主要由于20%IgG含有Fab糖基化修饰(高唾液酸化);血浆IgG含有Bisecting GlcNAc和Neu5Ac,CHO表达的曲妥珠单抗则没有。
唾液酸还有可能对炎症反应起到介导作用,虽然并无确论,但的确发现非人源的唾液酸修饰NGNA会引起严重的炎症反应。
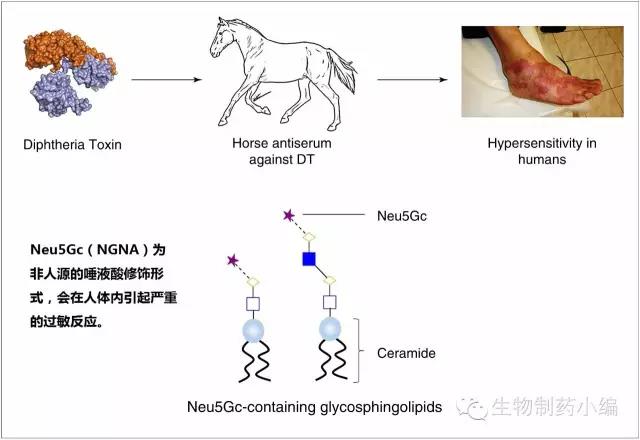
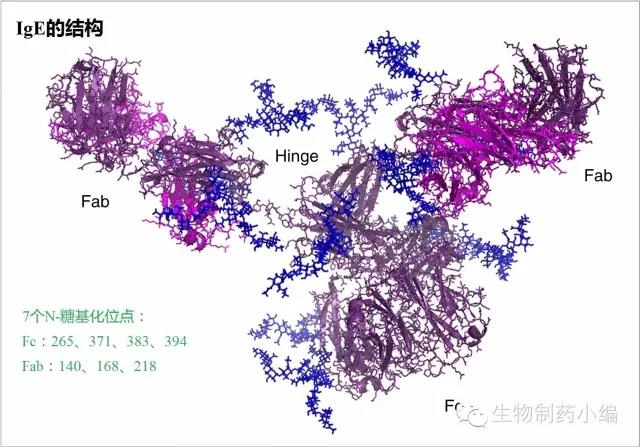
尽管抗体药物生产工艺发展迅速,过敏反应仍有1-3%的发生率。目前已经证实糖基化组分导致的过敏反应主要是由IgE介导的。在Chung等人进行的一项标志性的研究中,发现西妥昔单抗的过敏反应案例即源于抗α-gal的IgE抗体。有意思的是,西妥昔单抗的过敏反应与Fab的α-gal有关,与Fc的α-gal无关,因为前者与IgE接触面更大更容易结合。在同样用Sp2/0、NS0细胞系表达的英夫利昔单抗、帕立珠单抗中虽然也有微量α-gal,但不会引起过敏反应,因其发生在Fc域。
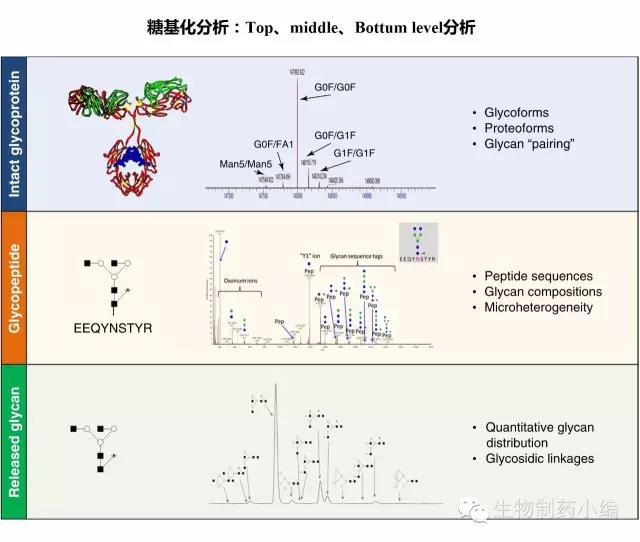
糖基化分析可以从三个维度进行:全分子分析、糖肽分析和releasedglycan分析。
单糖的确定则需要借助一系列糖苷酶:

通过多个糖苷酶依次酶切即可鉴定单糖组分。
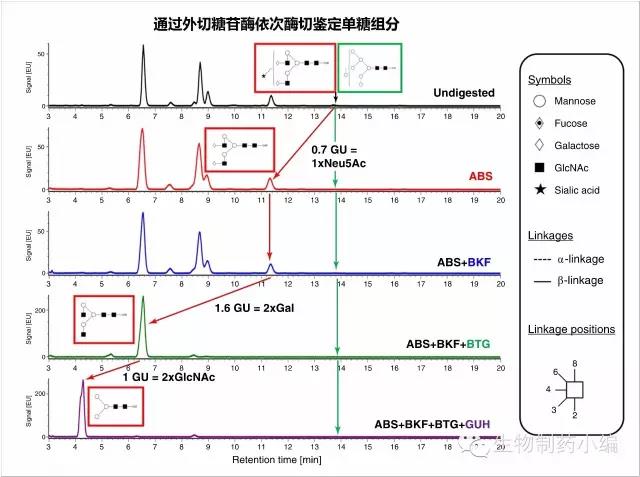
Releasedglycan的分析是抗体药物糖基化分析非常重要的部分,借助PNGase F切掉N-glycan,通过荧光分子如2-AB标记,借助UPLC分离进行分析。

近年来两种基于N-hydroxy succinimide-activated carbamate的新标记方法已经出现:RapiFluor-MSTM (RFMS) 和 6-aminoquinolyl-N-hydroxy succinimidyl carbamate (AQC) ,样品准备的时间大大缩短,效率得到明显提高。
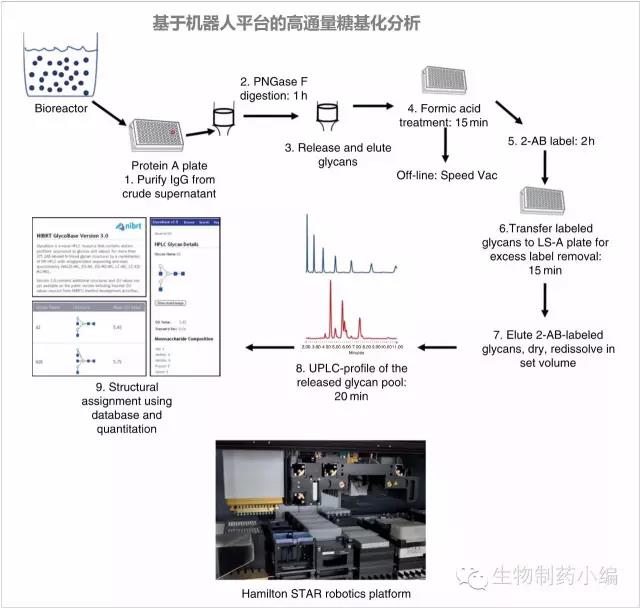
必要时可以采取基于机器人的高通量糖基化分析平台。
糖基化分析案例:ESI(电喷雾离子化)源与高分辨质谱联用是检测蛋白分子量的常用手段。以单克隆抗体为例,其完整分子量接近150kDa,在ESI源内可携带上多个电荷(40-70左右)使得单抗的质荷比(m/z)范围在2500-3500之间。在此m/z区域内,TOF和Orbitrap等高分辨质谱均可以分辨单克隆抗体的不同糖型。
以Rituximab为例进行说明。Rituximab的结构下图所示,是一个经典的IgG1抗体。和大多数药用单抗一样,仅在Fc区域有一个N糖基化位点。

▲Rituximab分子结构简图
Rituximab经过RP-LC分离后,经Q-Exactive质谱仪检测得到的完整分子量质谱图。
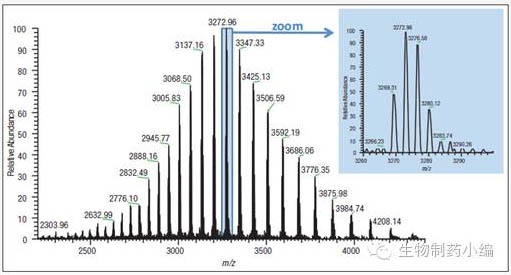
如上图,Rituximab的m/z落在1800-5000范围内,呈现蛋白大分子的典型电荷分布。图中丰度最高价态为+45,将其放大(zoom)后可以明显看到四种分布最高的糖型修饰被很好的分离。原始质谱图经软件去卷积化处理后,结果如下图。从图中可以看出,在完整分子量水平上,可以判断单抗的主要糖型为G0F/G0F、G0F/G1F、G1F/G1F(或G0F/G2F)和G1F/G2F。
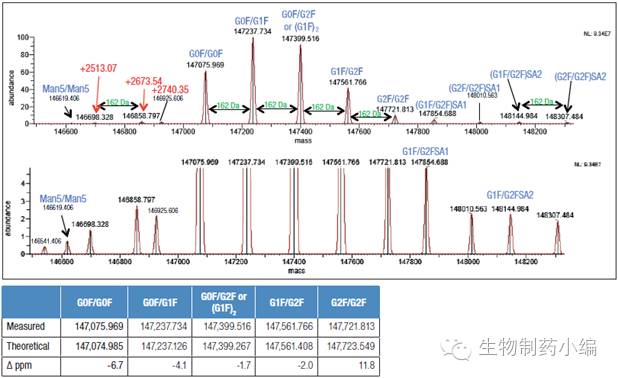
▲ Rituximab MS去卷积化处理后的糖型(top)
五个含量最高糖型与理论分子量的对比(table)
单抗经过DTT还原可将链间二硫键打开,得到独立的轻链(LC)和重链(HC)。LC和HC经RP-LC分离后,依次进入质谱中检测。结果如下图所示,图A为LC和HC的色谱峰,图B为LC对应的质谱图,图C为HC对应的质谱图。
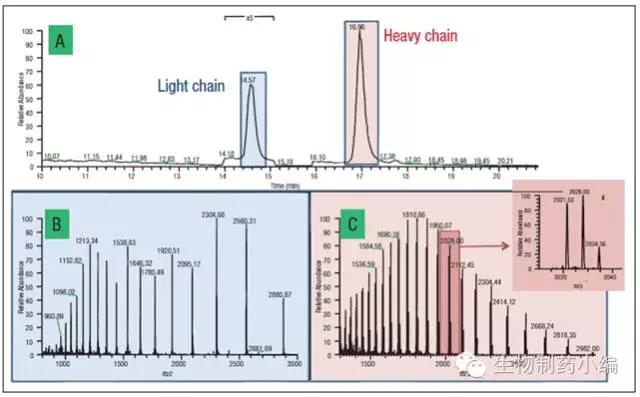
▲(A)Rituximab还原后LC和HC的色谱峰;(B) LC的质谱图;(C)HC的质谱图。图 C中插入的图谱为 z=+25部分的放大, 显示了代表3个不同糖型的峰图
将HC用软件去卷积化处理后,结果在下图中。单抗的主要糖型G0F、G1F和G2F清楚的显示在谱图中。在下图的表格中,G0F(50514.055)、G1F(50676.484)和G2F(50838.453)各糖型修饰的HC的分子量都有对应的强度(sumintensity)信息,根据此强度信息可以粗略估算G0F、G1F、G2F的相对比列。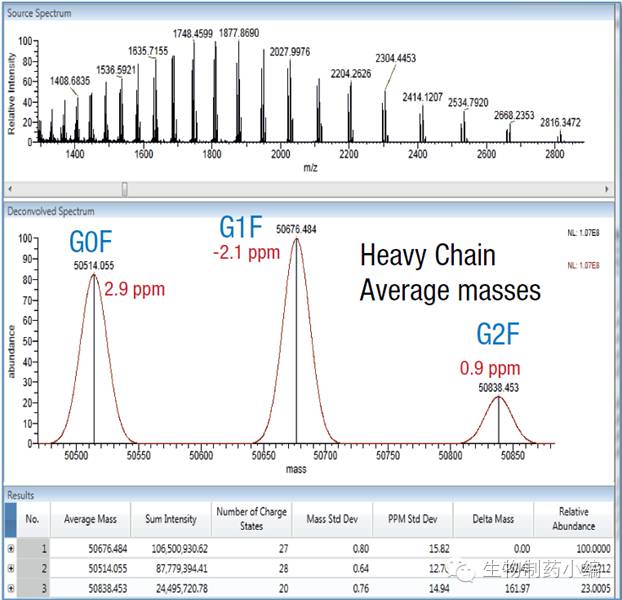
从以上IgG1单克隆抗体例子可以看出:与完整蛋白相比,质谱检测还原得到LC和HC会落在更低的m/z范围和得到更高的分辨率,从而提高了检测的精确度。并且,完整分子量两条HC各有一个糖基化位点,检测到分子量差异为两个糖基化位点的糖型组合,还原分子量中HC的糖型会更简单明确。如果抗体上有两个N糖基化位点,如西妥昔单抗,除了Fc区的N糖基化位点外在Fab区的重链还有一个N糖基化位点。在这种情况下,可利用Papain酶在铰链区将单克隆抗体切断,后经DTT还原得到LC(light chain)、Fab heavy chain和Fc/2片段,分别检测Fab heavy chain和Fc/2的分子量,以分别对Fab区的N糖基化和Fc去的N糖基化进行分析。具体数据在本文中,不再赘述。
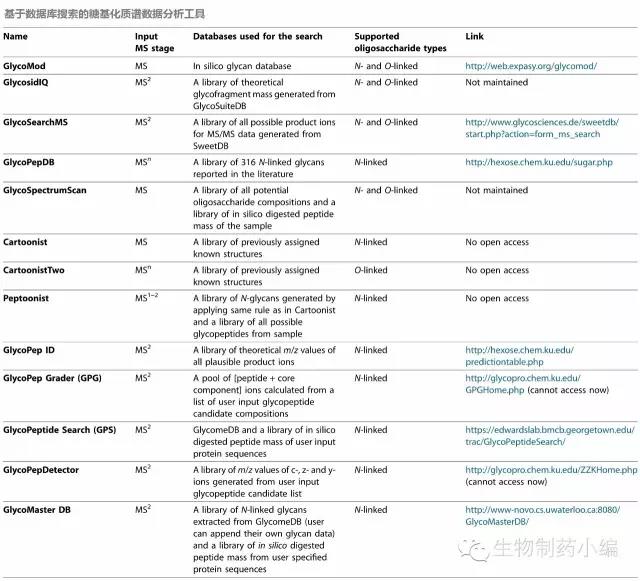
糖型数据库:基于质谱的检测数据,可以利用一些数据库搜索工具来分析糖基化Profile。下表列举了常用的基于库匹配(library match)的搜索引擎,如GlycoMed是一种网络搜索工具,其数据库源自预生成的silico library of glycan mass。
其他糖肽分析:除单克隆抗体外,融合蛋白、酶、凝血因子等药用蛋白都多个糖基化位点。对于多个糖基化位点的样品,N-Glycan released 分析方法不能特异性的解析出各位点的糖基化修饰的情况。而糖肽分析可以鉴定糖基化位点、解析寡糖结构和得到位点特异性的糖型修饰信息。糖肽的样品处理流程并不复杂,在糖蛋白经变性还原处理后,用蛋白水解酶(如trypsin)将蛋白水解成特定的肽段后进入LC-MS中分析。糖肽分析有很多优点并有重要意义,但同时糖肽也具有很多挑战性。糖肽的分析方法比N-Glycan released方法更加复杂:糖基化肽段的离子化效率较低,且寡糖糖链比肽段骨架更容易碎裂,糖肽的MS/MS谱图非常复杂给数据分析带来很多的困难。
以Charles C等人的糖肽分析方法为例对糖肽分析做简单的介绍。该方法将bovine lactoferrin(包含N糖)、kappa casein(包含O糖)和bovine fetuin(包含N糖和O糖)混合制成糖蛋白混合物,这些糖蛋白含有丰富的糖基化位点。该糖蛋白混合物的糖肽分析流程如下图所示。糖蛋白混合物经PronaseE水解肽段,在SPE柱脱盐和富集之后,由Nano-LC/Q-TOFMS检测并采集数据。数据由in-house软件Glycopeptidefinder分析。
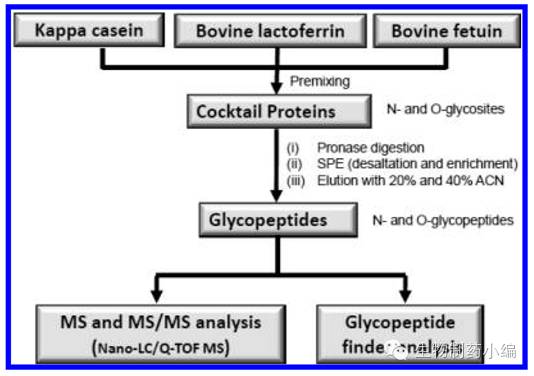
▲N-糖肽和O-糖肽复杂混合物的处理流程
在此方法中使用非特异性的蛋白水解酶PronaseE可以在同一个糖基化位点上得到不同大小的肽段,特异性蛋白水解酶(trypsin)得到肽段单一可能会因肽段过大等原因不容易被质谱检测到,PronaseE的非特异性酶切在一定程度上避免了这个问题。
糖肽的匹配是基于一级精确分子量(MS)和二级碎片离子信息(MS/MS)。当实测的质量与糖肽的理论质量在20ppm内,MS/MS的信息可以进一步提供可靠和清晰的确认。在CID碎裂模式下,糖肽会产生一些糖碎片特征峰(见下表),这些碎片可以作为糖肽的标志。
|
质荷比(m/z) |
组成 |
|
204 |
(HexNAc+H)+ |
|
366 |
(HexNAc+Hex+H)+ |
|
292 |
(Neu5Ac+H)+ |
|
274 |
(Neu5Ac-H2O+H)+ |
|
657 |
(HexNAc+Hex+Neu5Ac+H)+ |
下图为三个糖肽MS/MS谱图的去卷积化之后的信息,图中清晰的展示了CID模式下糖肽的MS/MS谱图由糖的碎片和肽段上连接不完整寡糖碎片组成。
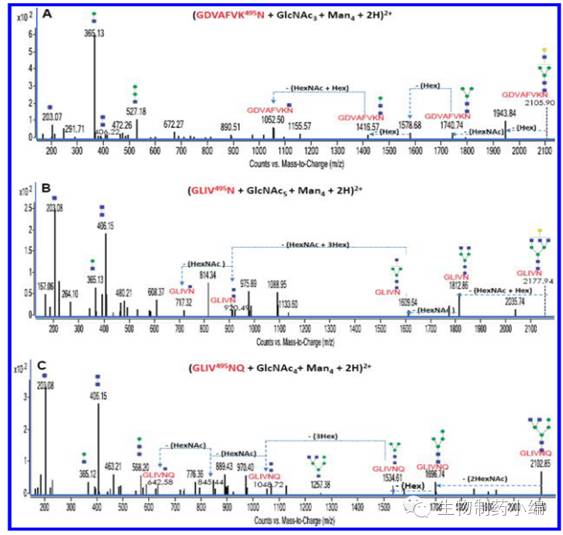
▲(A-C)Bovine lactoferrin处理后三个糖肽MS/MS谱图的去卷积化信息. 绿圈为甘露糖,黄圈为半乳糖,蓝方块为GlcNAc.
在对糖肽进行匹配之后,可以在TIC图提取各个糖肽的EIC图。下图是一张有代表性的糖肽的EIC谱图。下表中罗列出糖蛋白混合物中一部分糖肽的信息。
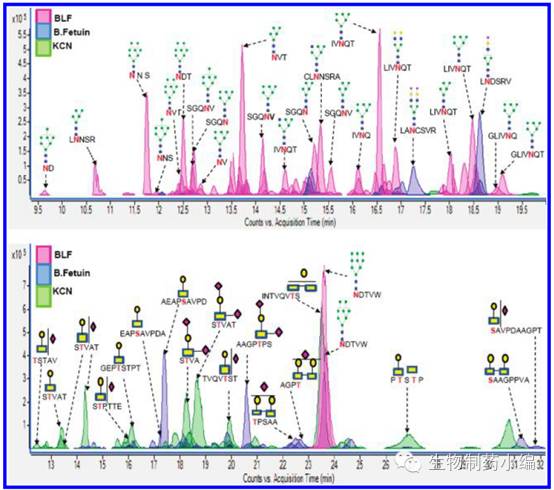
▲(A)20% ACN固相萃取糖肽的ECC信息;(B)40% ACN固相萃取糖肽的ECC信息。ECC: Extracted compound chromatogram.
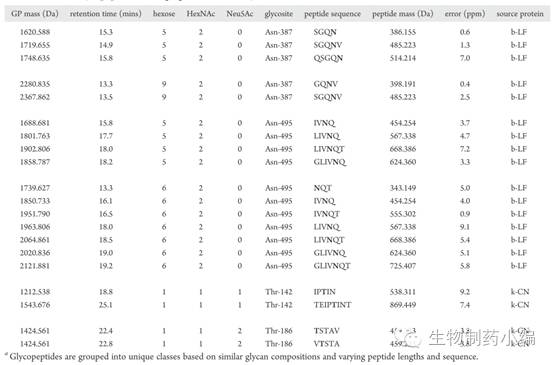
对bovine lactoferrin(包含N糖)、kappa casein(包含O糖)和bovine fetuin(包含N糖和O糖)糖蛋白混合物的糖肽LC-MS数据分析,共检测到233条糖肽信息,此三个蛋白一个包含18个糖基化位点。糖基化位点和各位点上糖型见上图。
N-glycan自身的合成
首先是N-Glycan自身的合成。N-glycan的合成从内质网膜开始,核糖UDP-GlcNAc上的phospho-GlcNAc转移到Dolichol-phosphate(多萜醇磷酸),形成Dol-P-P-GlcNAc。随后一次加上1个GlcNAc、5个Mannose(甘露糖),每一步反应都由特定的酶催化,修饰的位置也是严格固定的。这些酶以ALG(Asparagine-Linked Glycosylation)命名,每个酶由独立基因编码。
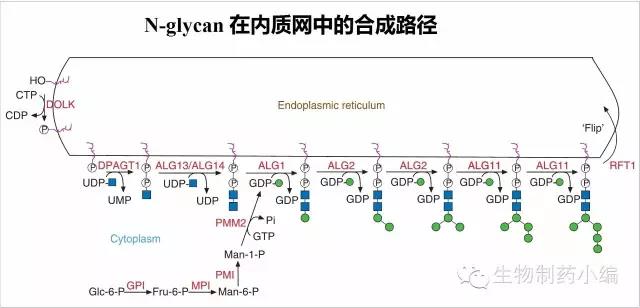
形成的Dol-P-P-GlcNAc2Man5是一个节点,该中间体将有膜表面进入到内质网腔内,继续后续的糖基化修饰。
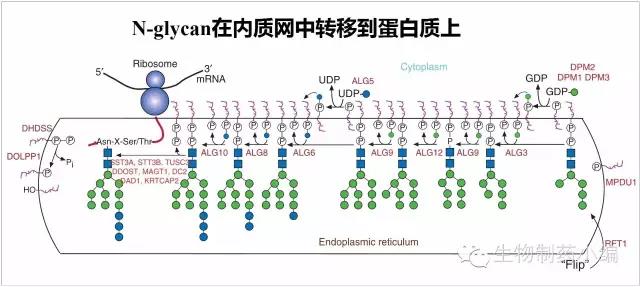
N-glycan连接到蛋白质上
在内质网腔中,Dol-P-P-GlcNAc2Man5会继续加上4个Mannose、3个Glc(葡萄糖),形成14个单糖组成的N-Glyan:Dol-P-P-GlcNAc2Man9Glc3,成熟的N-Glycan被连接到刚刚进入内质网的蛋白质N-糖基化位点上Asn-X-Ser/Thr上。
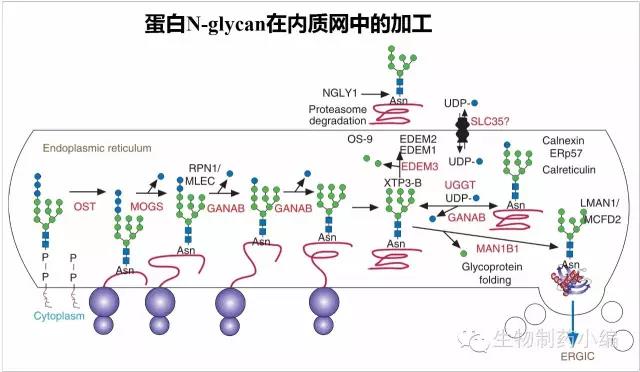
N-glycan在内质网中的加工
蛋白质加上Dol-P-P-GlcNAc2Man9Glc3以后,会继续进行糖基化的加工,同时完成蛋白折叠。N-glycan和N-glycan结合的分子伴侣在蛋白质折叠过程中起到关键作用。首先是膜上的糖苷酶MOGS水解掉一个Glc,然后游离可溶的糖苷酶GANAB水解掉第二个Glc,产生的Glc1Man9GlcNAc2在分子伴侣calnexin(钙连接蛋白)或者calreticulin(钙网织蛋白)的作用下进行折叠。折叠的同事,最后一个Glc被GANAB水解掉,如果此时折叠仍未完全,一种糖苷转移酶UGGT会结合到疏水口袋,并加上一个Glc,然后在分子伴侣帮助下继续折叠,这个循环进行直到折叠完全。正确折叠的Man9GlcNAc2修饰蛋白被XTP3-B识别并保护,然后中央的一个Mannose被内质网内甘露糖苷酶ERMAN1水解掉,形成Man8GlcNAc2,后者被LMAN1/MCFD2复合物中的ERGIC-53识别,转运到ER-Golgi intermediate compartment(ERGIC)中。对于没有正确折叠的糖蛋白,在不同阶段会在蛋白酶体或者ERAD途径被降解。
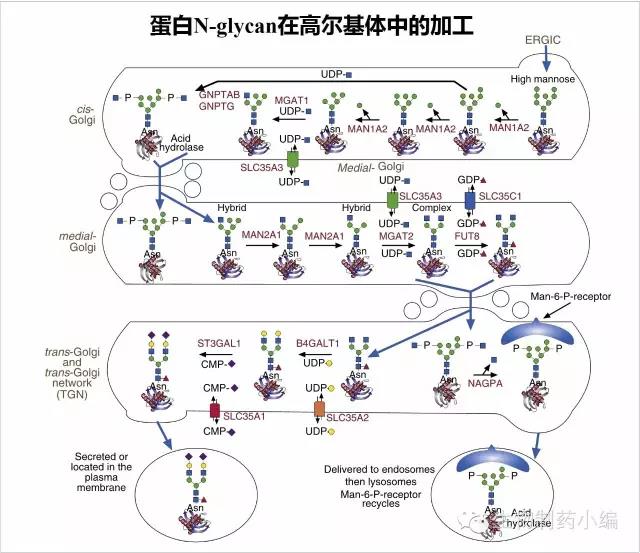
N-glycan在高尔基体中的加工
N-glycan在高尔基体中将进一步加工成熟。如果在内质网中,N-glycan的葡萄糖没有完全切掉,高尔基体endo-甘露糖苷酶将从Mannose处切断,释放Glc1-3Man。末端的Mannose被高尔基体I型甘露糖苷酶MAN1A2依次切掉,形成Man5GlcNAc2。MGAT1识别该底物,加上一个GlcNAc,如果不继续加工,会在中间高尔基体加上一个Gal和唾液酸,形成一个Hybrid的糖型。但一般情况下,Man5GlcNAc会被高尔基体II型甘露糖苷酶MAN2A1切掉两个Mannose,并在MGAT2的作用下加上第2个GlcNAc形成GlcNAc2Man5GlcNAc2。该糖型可作为多种糖苷转移酶的底物,如MGAT4、MGAT5、MGAT6等,所以会形成分支型的复杂N-glycan。
在更多情况下,进入反式高尔基体后,通过FUT8的催化,会在Asn连接的GlcNAc上加上一个岩藻糖。随后在一种半乳糖苷转移酶B4GALT1的作用下,在2个末端的GlcNAc上各加上一个Gal(半乳糖)。然后在一种唾液酸转移酶ST3GAL1的作用下,在2个末端的Gal上各加上一个唾液酸(至少存在5种以上的唾液酸转移酶)。最终成熟的N-glycan修饰蛋白从高尔基体分泌出来。
上市的抗体药物基本限于Fc的单一N-糖基化修饰,但因其糖型组分和含量不一致,仍有一定复杂性,尤其给生产稳定性和类似药开发带来了挑战。

不同物种的糖基化是不同的。
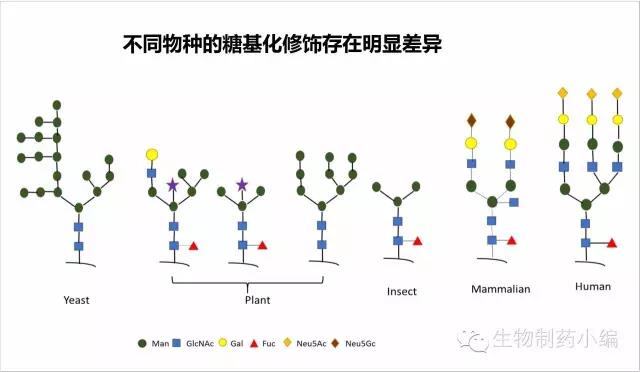
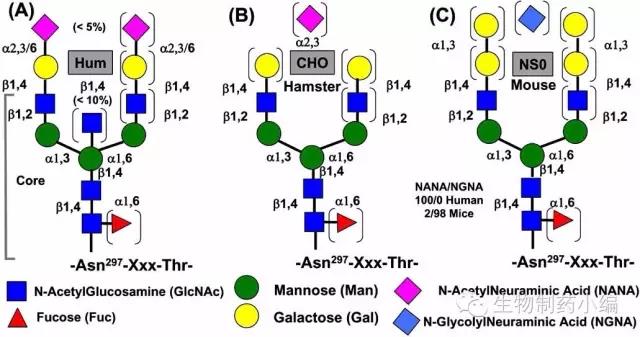
细胞系的影响:工业上常用的CHO、NS0细胞系,其糖谱和人源的并不完全一致。
如前文所述,抗体药物的糖基化修饰过程极为复杂,而且与纯化工艺也有关系,因而糖基化修饰的过程必定受到多种因素的协同影响。

随着抗体药物的快速发展,业界已经积累了关于糖基化修饰影响因素和机制的有限了解,这些案例的积累进一步促进糖型和控制,并进一步助推其机制的深入研究。
表二细胞培养过程影响糖基化修饰的因素
|
影响因素 |
对抗体糖基化修饰的影响 |
|
Mn2+ |
高Mn2+浓度容易形成高甘露糖修饰; 高Mn2+浓度容易形成高半乳糖修饰(同时添加半乳糖和尿苷); |
|
葡萄糖 |
高葡萄糖浓度容易形成高唾液酸修饰和高半乳糖修饰; 低葡萄糖浓度导致糖基化程度降低; |
|
丁酸钠 |
丁酸钠的存在导致唾液酸修饰和半乳糖修饰程度降低; |
|
谷氨酰胺 |
高谷氨酰胺浓度导致半乳糖修饰和唾液酸修饰程度降低; |
|
氨基酸 |
高浓度色氨酸、天冬氨酸、异亮氨酸导致唾液酸修饰程度升高; 高天冬酰胺浓度导致半乳糖修饰程度降低; |
|
血清 |
无血清培养基导致糖基化异质性降低; 无血清培养基导致更高的唾液酸修饰和更低的半乳糖修饰; |
|
溶解氧 |
波动的溶氧导致triantennary糖型和唾液酸修饰糖型升高; 低溶氧导致更低的半乳糖修饰和更高的唾液酸修饰; |
|
pH |
低pH导致高唾液酸修饰; 高pH导致末端半乳糖修饰降低、岩藻糖修饰升高; |
|
温度 |
低温导致糖型没有加工成熟(由于基因表达下调); |
|
渗透压 |
高渗透压导致更高的高甘露糖修饰; 高渗透压导致更低的岩藻糖修饰(70% at 285 mOsm/Kg、 40% at 345 mOsm/Kg); |
|
细胞系 |
加入Bisecting-GlcNAc导致ADCC活性增加; |
注:相互关系引自文献案例。
抗体药物的快速发展,促进工业界越来越重视糖基化的修饰过程、分析、控制、SAR关系,其复杂程度要求从更宏观和整体的角度来审视。工业界的努力也带来了许多变化,从重点关注分析到控制,从优化稳定细胞培养工艺到糖基化改造,从形式分析到SAR分析,如类似药糖基化可比性研究、糖基化改造在迭代抗体药物、PD-1/PD-L1抗体药物中的抗体亚型/糖基化改造差异性选择策略,都将积累更多的数据和经验,推动对糖基化更深入的理解。
感谢某匿名朋友帮助撰写了糖基化分析部分的内容。
参考资料:
Challenges of glycosylation analysis and control=an integrated approach to producing optimal and consistent therapeutic drugs(2016);
N-linked glycans(2016);
N-glycosylation heterogeneity and the influence on structure, function and pharmacokinetics of monoclonal antibodies and Fc fusion proteins(2016);
GlycoFi s technology to control the glycosylation of recombinant therapeutic proteins(2009);
Glycosylation of Therapeutic Proteins(2010);
The Emerging Importance of IgG Fab Glycosylation in Immunity(2016)
Glycosylation of Monoclonal Antibody Products =Current Status and Future Prospects(2016)
LC/MS Analysis of the Monoclonal Antibody Rituximab Using the Q Exactive Benchtop Orbitrap Mass Spectrometer;
A Complete Workflow Solution for Intact Monoclonal AntibodyCharacterization Using a New High-Performance Benchtop Quadrupole-OrbitrapLC-MS/MS;
Charles C. Nwosu,Richard R. Seipert, John S. Strum, Serenus S. Hua, Hyun Joo An, AngelaM. Zivkovic, Bruce J. German, and Carlito B. LebrillaSimultaneous and ExtensiveSite-specific N- and O-Glycosylation Analysis inProtein Mixtures