
2016年,FDA下属CDER共批准了19个新分子实体:包括12个NDA、7个BLA。这个数字为2008年来新低,但数字背后是小分子新药锐减,生物制品则热度不减。CBER则批准了4个新药(新分子实体),包括2个凝血因子VIII药物Kovaltry和Afstyla、凝血因子IX药物Idelvion和口服霍乱疫苗Vaxchora。后文未特殊说明的,分析范围限于CDER批准的新药。
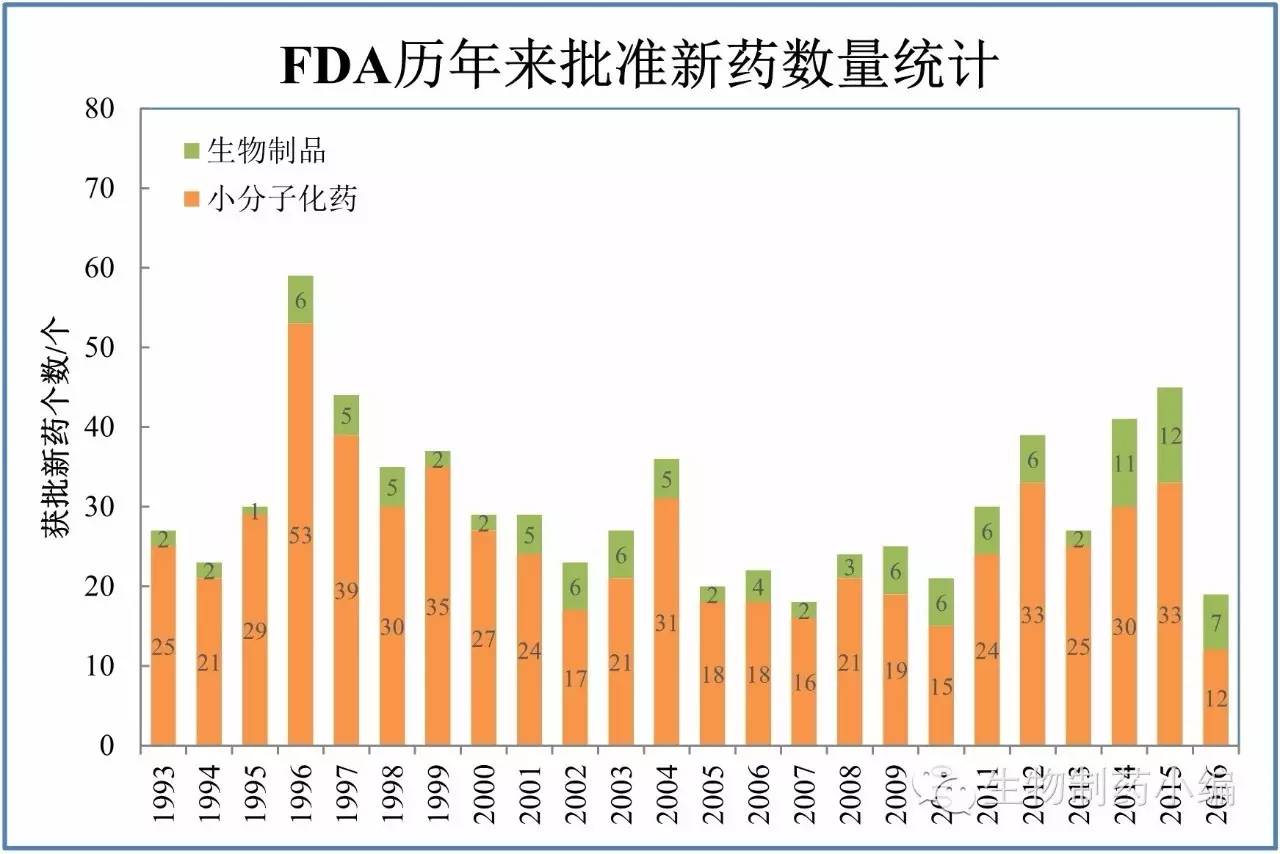
尽管数量不多,但今年获批的新药质量颇高:包括首个真正意义上的蛋白相互作用抑制剂(PPI)Venclexta、首个PD-L1抗体Tecentriq等。抗体药物的表现更是让人眼前一亮,抗菌抗体(3个)、哮喘抗体等,适应症更加广泛,再次体现了抗体药物的巨大潜在应用价值。生物类似药并非新药,但今年是具有里程碑意义的一年,FDA共批准了3个抗体类似药,是整个抗体药物领域转折点意义的一年,这里也一并讨论。
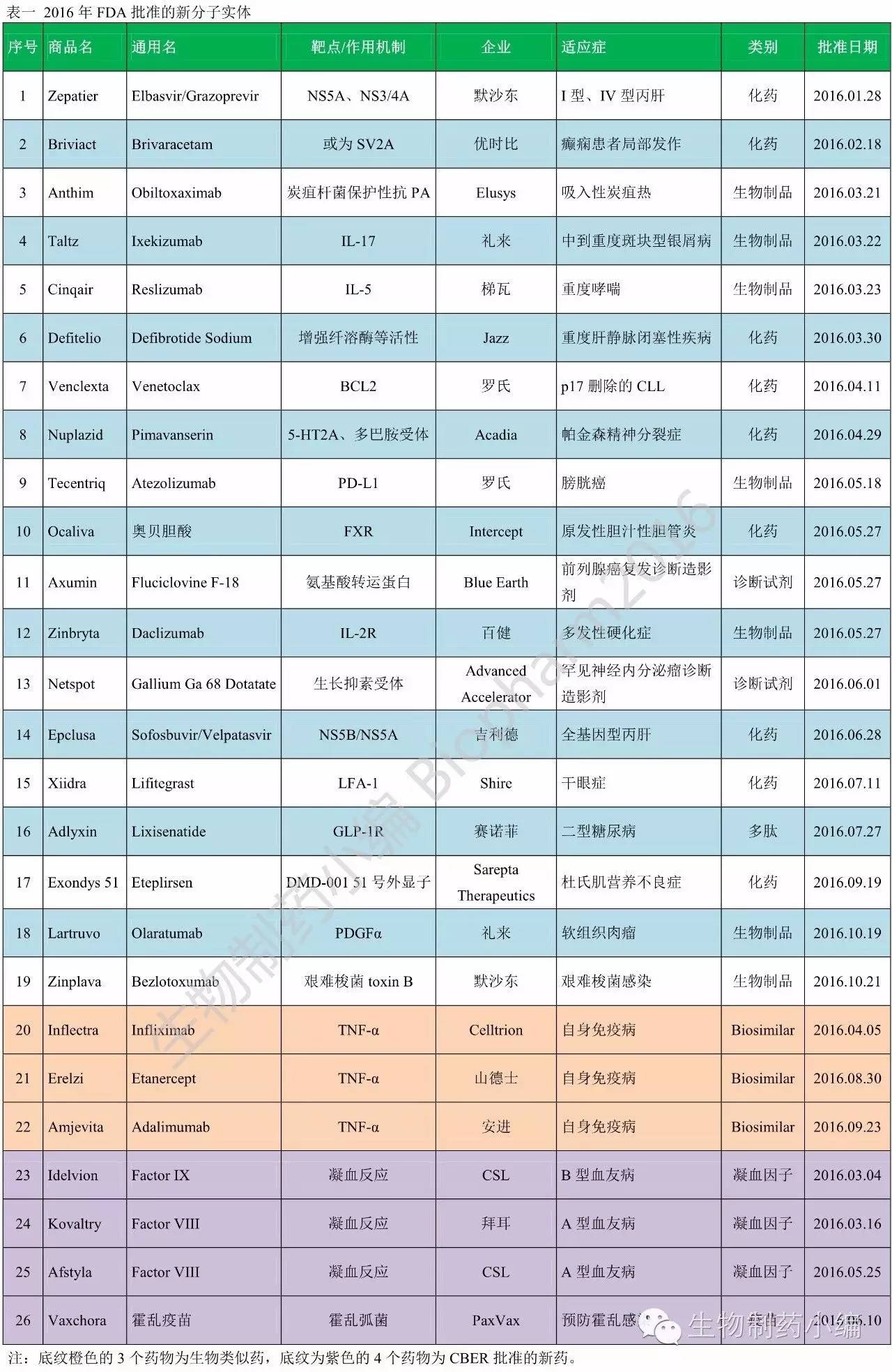
2016年FDA批准的新分子实体具体如下表。
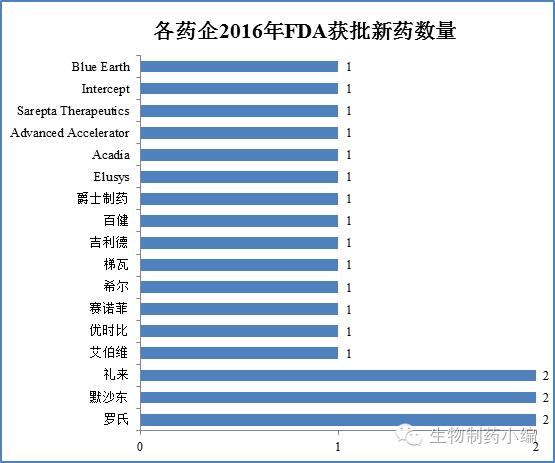
罗氏、默沙东、礼来各有2个新药获批,艾伯维、赛诺菲、吉利德、梯瓦等巨头各有1个新药获批,中小药企则有不俗表现。
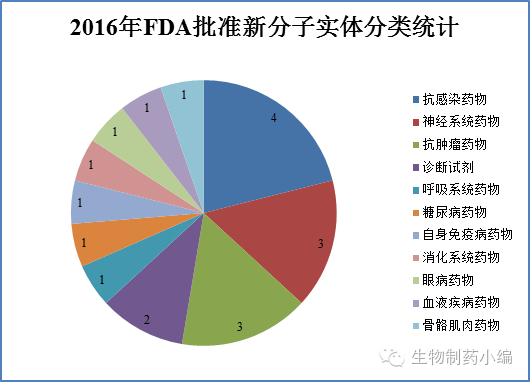
从治疗领域来看,2016年FDA批准新药包括:
4个抗感染药物:抗丙肝药物Zepatier、Epclusa,抗炭疽热药物Anthim 和抗艰难梭菌感染药物Zinplava;
3个神经系统药物:抗癫痫药物Briviact、帕金森精神病药物Nuplazid和多发性硬化症药物Zinbryta;
3个抗肿瘤药物:CLL药物Venclexta、膀胱癌/肺癌药物Tecentriq和软组织肉瘤药物Lartruvo。
免疫学实际上有2个药物:银屑病药物Taltz和哮喘药物Cinqair(作用机制为免疫调节,归为呼吸系统药物)。
1.Zepatier
公司:默沙东
获批日期:2016年1月28日
简介:Zepatier是默沙东研制的一种口服丙肝药物组合,其中Elbasvir是靶向NS5A,Grazoprevir靶向NS3/4A。适应症为基因1、4型丙肝,2016年前三个季度销售额分别为5000万、1.12亿、1.64亿美元。目前丙肝领域最畅销的药物依次为:Harvoni、Sovaldi、Epclusa、Viekira Pak、Daklinza、Zepatier。
2.Briviact
公司:优时比
获批日期:2016年2月19日
简介:左乙拉西坦曾经是最畅销的抗癫痫药物,布瓦西坦(Briviact)与左乙拉西坦结构相似,SV2A结合力增强10倍,为新一代抗癫痫药物,其生物利用度更高、达峰时间段,市场前景看好。
3.Anthim
公司:Elusys Therapeutics
获批日期:2016年3月18日
简介:Anthim是2016年首个获批的抗体药物,靶点为炭疽杆菌的保护性抗原PA。由于适应症为炭疽热,没有进行人体药效学试验,但进行了320名健康志愿者的安全性试验,证实安全性良好。

4.Taltz
公司:礼来
获批日期:2016年3月22日
简介:Taltz是一种靶向IL-17A的单克隆抗体药物,为同类药物的second-in-class,该类药物中首个获批的是诺华的Cosentyx。更多信息科参见前文:FDA批准第2个IL-17靶点抗体药物:礼来Taltz。

IL-17抗体被证实是疗效明显胜过Enbrel的自身免疫病药物,2016年Cosentyx销售额将突破亿美元,Taltz上市前两个季度销售额分别为1900万美元、3300万美元。

5.Cinqair
公司:梯瓦
获批日期:2016年3月23日
简介:近年来炎症反应在哮喘适应症中的机理研究逐步深入,催生了很多相应靶点抗体药物的开发。Cinqair是FDA批准的第二个IL-5抗体,第一个为葛兰素史克开发的Nucala,后者与2015年11月获批。
6.Defitelio
公司:爵士制药
获批日期:2016年3月30日
简介:Defitelio是从猪小肠提取的寡核苷酸混合物,分子量13-20kDa,治疗费用为4.7万美元/人年。由于制备工艺的专利仅保护到2017年,爵士制药申请了分析方法的专利将保护期延至2032年。2015年,Defitelio在欧洲市场的销售额为7000万美元,随着美国市场的进入,其销售额在2016年前三季度达到8000万美元,成为爵士制药旗下第三畅销药物。
7.Venclexta
公司:罗氏/艾伯维
获批日期:2016年4月11日
简介:Venclexta的获批对于新药研发具有里程碑般的意义,因为其突破了传统药物化学的限制,是第一个真正意义上的蛋白相互作用(PPI)抑制剂。Venclexta是一种每日一次的口服药物,适用于采用FDA批准的一款伴随诊断试剂盒Vysis CLL FISH探针试剂盒确认为存在17p删除突变的CLL患者。

8.Nuplazid
公司:ACADIA Pharmaceuticals
获批日期:2016年4月30日
简介:Nuplazid是一种血清素受体反相激动剂,靶向5-HT2A受体,降低其活性,从而减少中枢神经系统的兴奋程度。Nuplazid也是首个获批用于治疗出现幻觉/妄想等精神疾病的帕金森症的药物。

9.Tecentriq
公司:罗氏
获批日期:2016年5月18日
简介:Tecentriq是首个获批的PD-L1抗体药物,首个获批的适应症为膀胱癌,这也是30年来针对转移尿路上皮癌的首个新药。10月18日,FDA批准Tecentriq用于转移性非小细胞肺癌,至此形成PD-1/PD-L1三足鼎立的局面。更多信息参见前文:FDA批准首个PD-L1抗体药物:罗氏Tecentriq。
10.Zinbryta
公司:百健/艾伯维
获批日期:2016年5月17日
简介:Zinbryta的活性成分为CD25抗体Daclizumab(达利珠单抗),用于多发性硬化症。实际上,达利珠单抗并非一种新分子实体,1997年罗氏开发了达利珠单抗,用于器官移植的免疫抑制,以商品名Zenapax上市,由于销售表现不佳在2009年退市。百健在前者基础上针对新的适应症进行了有目的的工艺创新,得到了糖基化修饰一致性更好、ADCC活性更低的高产达利珠单抗。更多信息参见前文:Zinbryta、Zenepax对比分析:看达利珠单抗老药新用如何创新。
11.Ocaliva
公司:InterceptPharmaceuticals
获批日期:2016年5月27日
简介:Ocaliva(奥贝胆酸)在熊脱氧胆酸基础上优化开发的Me-better药物,用于治疗原发性胆汁性胆管炎(PBC)。与熊脱氧胆酸相比,奥贝胆酸增加了FXR结合活性,从而药物活性更高、剂量更低。
12.Axumin
公司:Blue Earth Diagnostics
获批日期:2016年5月27日
简介:Axumin为正电子发射计算机断层显像(PET)试剂,用于诊断患者前列腺特异性抗原(PSA)的升高,从而检测前列腺复发的可能性。

13.Netspot
公司:Advanced AcceleratorApplications
获批日期:2016年6月1日
简介:Netspot是一种镓68-donatate放射性注射剂,用于PET扫描城乡。FDA批准Netspot用于检测一种罕见神经内分泌肿瘤。

14.Epclusa
公司:吉利德
获批日期:2016年6月28日
简介:Epclusa是一种治疗丙肝复方制剂,活性成分包括靶向NS5B的sofosbuvir和靶向NS5A的velpatasvir。Epclusa可用于全部6种基因型丙肝患者,市场潜力巨大,上市第二季度销售额即达到6.4亿美元,成为仅次于Harvoni、Sovaldi的第三畅销丙肝药物。预计后续很快超过Sovaldi。
15.Xiidra
公司:Shire
获批日期:2016年7月11日
简介:Xiidra用于治疗干眼症,是一种特异性结合LFA-3的小分子,阻断LFA-3与ICAM-1的相互作用,而ICAM-1常在干眼症患者过度表达。Xiidra是13年来FDA批准的首个干眼症药物。目前市场上最主要的干眼症药物为爱儿健的Restasis(环孢霉素),2015年销售额为13亿美元。与Restasis相比,Xiidra起效更快(2周vs 6周),Shire也为Xiidra定下了与Restasis相当的价格,都在5000美元/年左右。预计Xiidra将对Restasis带来强大冲击。
16.Adlyxin
公司:赛诺菲
获批日期:2016年7月27日
简介:Adlyxin的成分为GLP-1受体激动剂利西拉来,该药物在欧洲以商品名Lyxumia上市。利西拉给药频率为一天一次,在强者如林的GLP-1受体激动剂市场很难有所作为。利拉鲁肽一直统治市场,一周一次bydureon紧随其后,近两年上市的一周一次度拉鲁肽强势进场,利西拉来并无任何明显优势。赛诺菲的布局重点在于推动利西拉来/甘精胰岛素复方制剂的开发,其直接竞争对手为诺和诺德的利拉鲁肽/德谷胰岛素复方制剂。更多信息参见前文:FDA同日批准2款基础胰岛素/GLP-1类似物复方制剂。
17.Exondys 51
公司:Sarepta Therapeutics
获批日期:2016年9月19日
简介:Exondys 51是FDA批准的首个杜氏肌营养不良症药物,其获批是近年来FDA批准药物中最具争议的。一方面Exondys 51的有效性非常模糊,另一方面咨询委员会明确拒绝,在这样情况下,FDA做出了批准的决定,超出市场预料,Sarepta股价应声暴涨100%。尽管充满争议,对于无药可用的患者来说,至少多了一次机会。更多信息参见前文:峰回路转:FDA批准首个杜氏肌营养不良症药物Exondys51.
18.Lartruvo
公司:礼来
获批日期:2016年10月19日
简介:Lartruvo(Olaratumab)靶向PDGFα,与多柔比星联合治疗成人软组织肉瘤(STS),这是40年来首个疗效显著优于必行单独用药的联合治疗方案。更多信息参见前文:FDA加速批准40年首个软组织肉瘤新药:礼来Lartruvo。

19.Zinplava
公司:默沙东
获批日期:2016年10月21日
简介:Zinplava(Bezlotoxumab)靶向艰难梭菌的Toxin B,用于治疗艰难梭菌感染。艰难梭菌的感染往往病情严重,复发率高,是后抗生素时代十分棘手的问题,感染率在过去20年间急速上升。仅2011年一年,美国感染人数达50万,死亡人数2.9万。Zinplava的获批,给患者带来新的希望。更多信息参见前文:抗菌类抗体药物:重回赛场。
20.Idelvion
公司:CSL
获批日期:2016年3月4日
简介:Idelvion由CSL开发,是第一款白蛋白融合型凝血因子IX,半衰期延长5倍,与百健上市的首个长效凝血因子IX(半衰期延长3倍)相比半衰期更长,给药频率可达到一周一次,可控后可达到每两周给药一次。更多信息参见前文:FDA批准第一个白蛋白结合凝血因子IX:Idelvion。
21.Kovaltry
公司:拜耳
获批日期:2016年3月16日
简介:Kovaltry是一种新的全长的、未经修饰的凝血因子VIII产品,采用BHK细胞表达,糖基化修饰与内源八因子类似,α-Gal和NGNA糖型的比例控制在1%以下。Kovaltry与Kogenate FS结构一致,主要是经过了一系列的生产工艺优化:
细胞株同时整合了HSP 70蛋白基因,有助于八因子的折叠;
优化了下游纯化工艺;
在去垢剂灭活病毒基础上,引入20N 纳滤除病毒;
细胞培养工艺中去除了人源和动物源性物质。
22.Afstyla
公司:CSL
获批日期:2016年5月25日
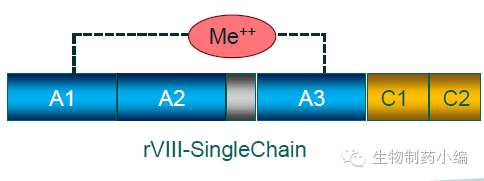
简介:Afstyla是首个单链结构的八因子,其半衰期与天然八因子类似,但稳定性明显提高,同时与vWF亲和力增强。Afstyla利用CHO细胞表达,轻重链连接区有一个新的N-糖基化位点,其他糖基化修饰与内源八因子类似。
 |
 |
23.Vaxchora
公司:PaxVax
获批日期:2016年6月10日
简介:Vaxchora由百慕大PaxVax Bermuda公司开发,获得FDA授予的快车道地位和优先审查资格,并获得一张热带病优先审查券。

Vaxchora是一种活的、弱毒疫苗,通过单次口服免疫,大约为3盎司液体,旅行者需在前往霍乱受灾国家和地区前至少10天服用。Vaxchora的有效性在一项随机、安慰剂对照、人体研究中得到证实。该研究共招募了197例18-45岁的志愿者。197例志愿者中,68例Vaxchora受试者和66例安慰剂受试者接受了口服霍乱攻毒。数据显示,在Vaxchora免疫10天的受试者中,Vaxchora预防霍乱的有效率达到了90%;在Vaxchora免疫3个月的受试者中,Vaxchora预防霍乱的有效率达80%。该研究中为有症状受试者准备了抗生素和液体替代治疗方案。
Add.生物类似药
2016年,FDA共批准了3个生物类似药:Celltrion的Inflectra(参照药为Remicade)、山德士的Erelzi(参照药为Enbrel)和安进的Amjevita(参照药为Humira)。
FDA在生物类似药的监管方面起步较晚,但近两年则进展迅速,毕竟这是全球最大的药物市场。2016年,FDA接连批准了3个生物类似药,在这3个案例中,也给更多布局生物类似药研发的企业许多可供借鉴的经验。从理化相似性评估策略、制剂专利规避、临床适应症选择/适应症拓展策略、知识产权纠纷等方面,都给后来者提供了更多参考。更多信息可参见小编前文: