
编者按
生物类似药的相似性研究,通常离不开药物物理化学的结构以及生化功能的研究。以FDA全面证据(Total of evidence)的生物类似药开发策略来看,结构与功能的研究是所有相似性研究的基础。而且从各地区的生物类似药指导条例来看,类似药和原研药的相似性研究往往需要多个批次、多个地区的数据以支持。最近,Samsung药业在Herceptin生物类似药开发过程中,意外发现Herceptin原研药多批次中影响ADCC功能的质量参数发生偏移,本文笔者介绍相关信息,并以此分享一下此事件对于工艺变更的启示。
Herceptin原研药多批次的质量参数偏移
Samsung药业在药物开发过程中,分析了有效期从2015年3月到2019年12月多个批次的Herceptin原研药。结果意外的发现,从有效期为2018年8月的批次开始,Herceptin的质量参数出现了第一次偏移, Afucose%(无岩藻糖)比例从之初的8%左右降低至4.7%左右,随之ADCC和FcγRIIIa也均减少了50%左右。随后,从有效期为2019年6月的批次开始,Herceptin的质量参数出现了第二次偏移,HW%(高甘露糖)比例从2.0%提高到5.0%左右,Afucose%恢复到6.0%以上(仍与8.0%左右有差距),HW%和Afucose%的总和基本恢复到原来10%左右水平,这样ADCC功能小有恢复,但仍然只是有效期为2018年8月之前的80-90%。此外,值得注意的是在这两次的偏移中,Galactosylation%均降至20%左右,比2018年8月之前的40%减少了一半左右。
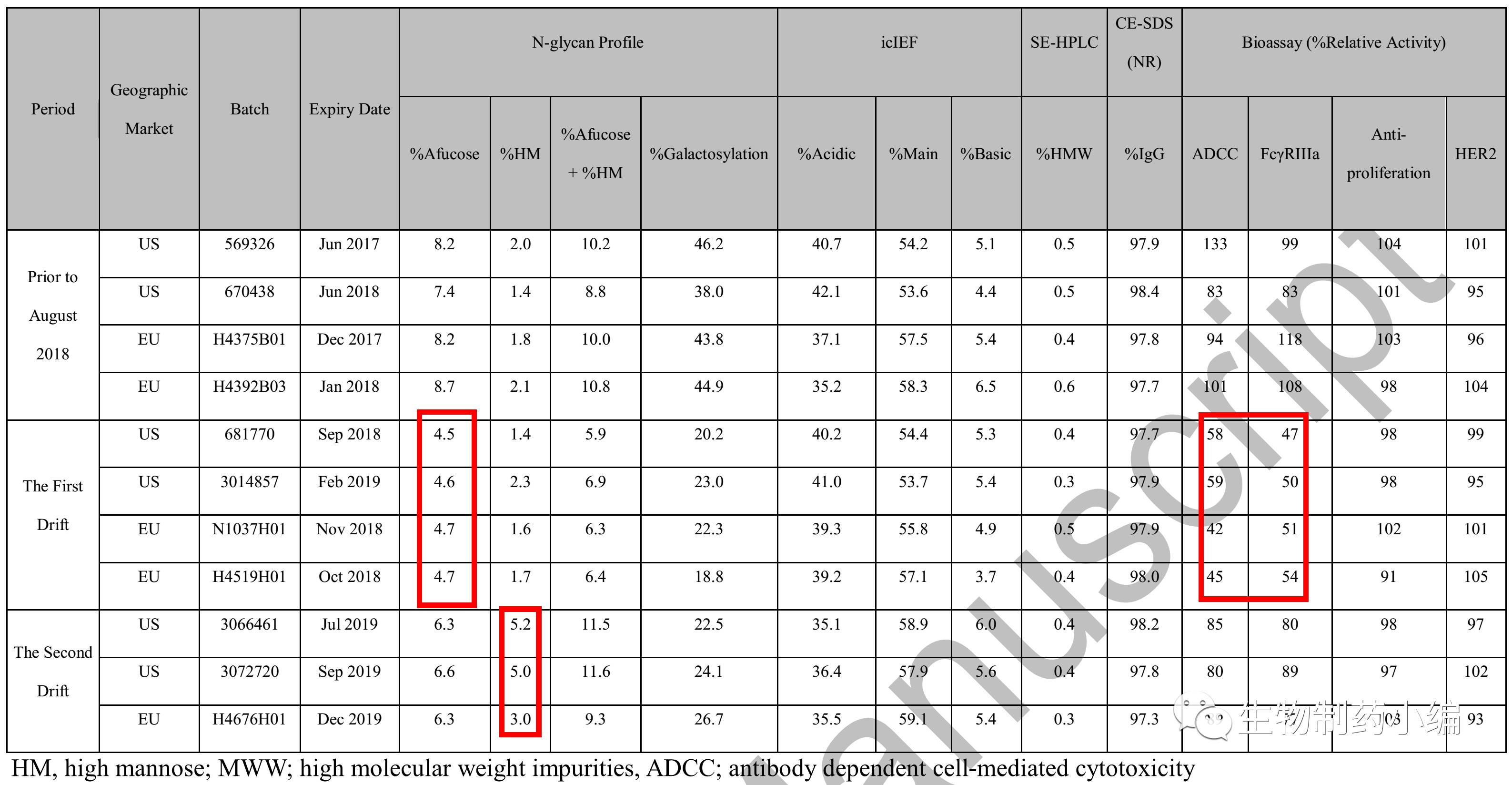
▲ 多批次Herceptin质量概述
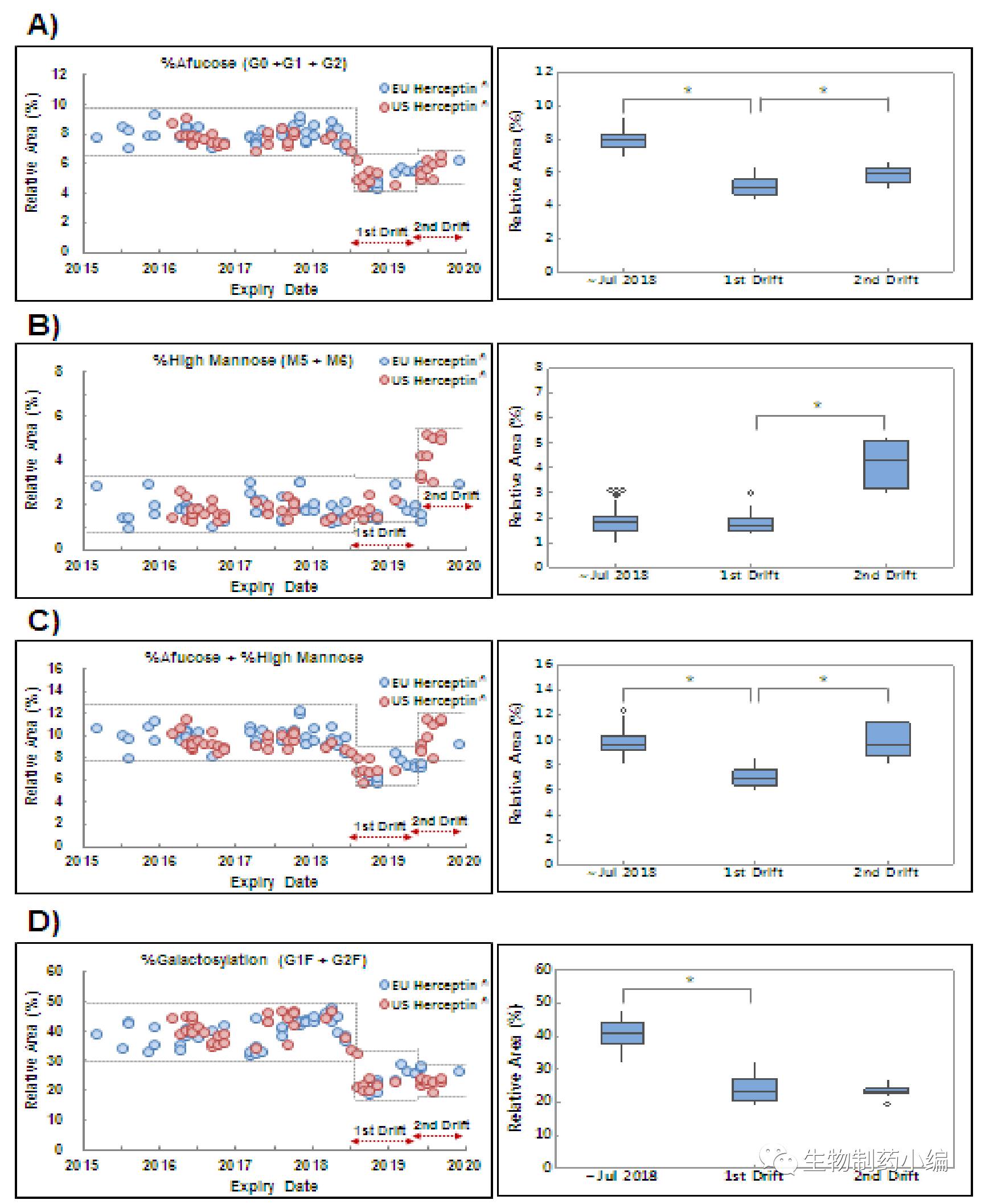
▲ 多批次Herceptin糖基化分布
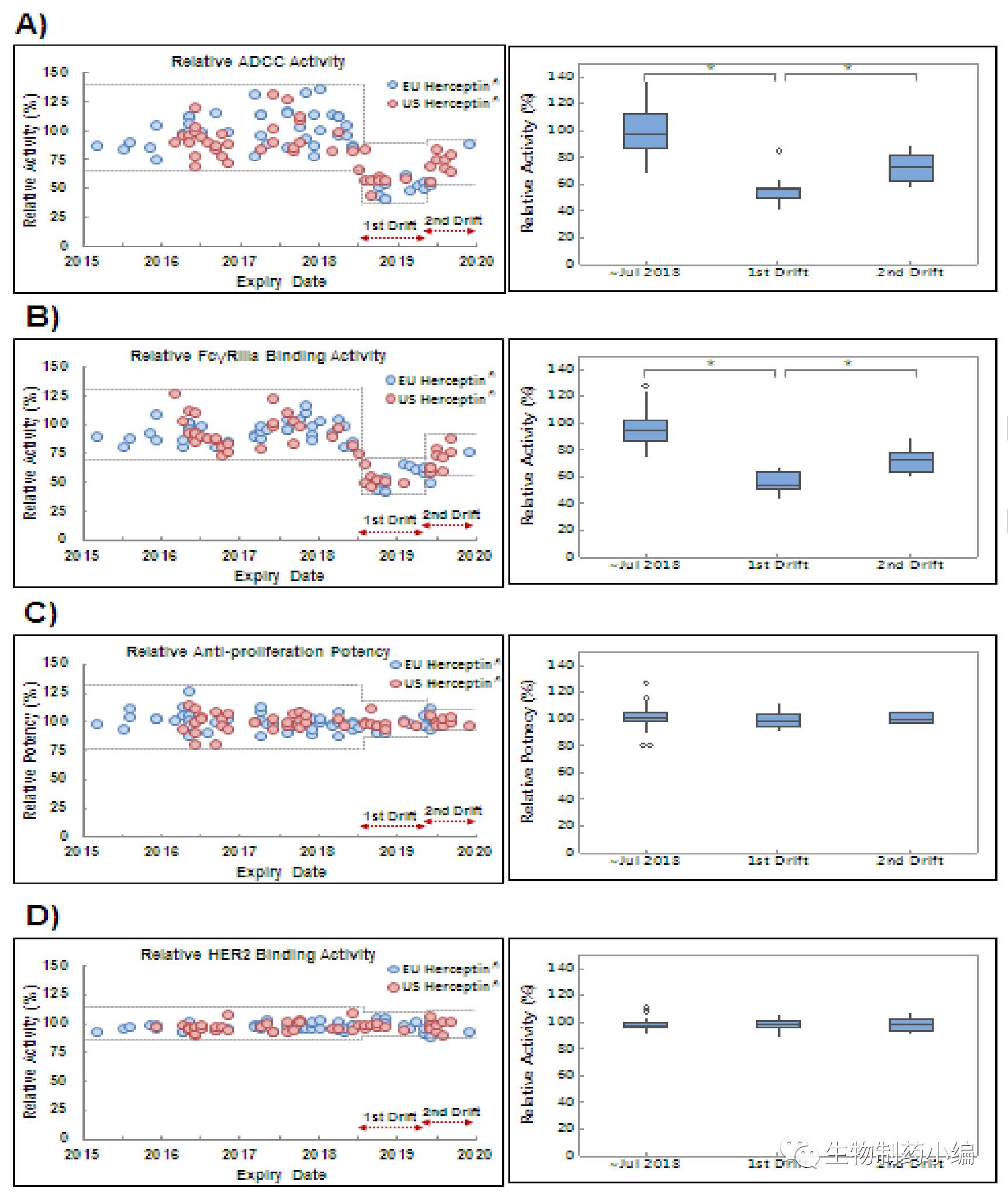
▲ 多批次Herceptin ADCC等生化功能
在两次有关糖基化质量参数偏移过程中,电荷异质性的变化并不明显。但值得注意的是,在有效期为2018年8月的批次之前,美国产的Hcerptin的酸性峰含量要高于欧洲产的。同时随着第二次高甘露糖的质量偏移,碱性峰的含量也有所增加,与早前笔者报道的有关电荷异质性的规律类似(抗体药物电荷异质性研究进展:碱性组分中分离出影响Fc功能的非岩藻糖化蛋白),当然两个维度的质量属性是否具有关联性仍不可知。
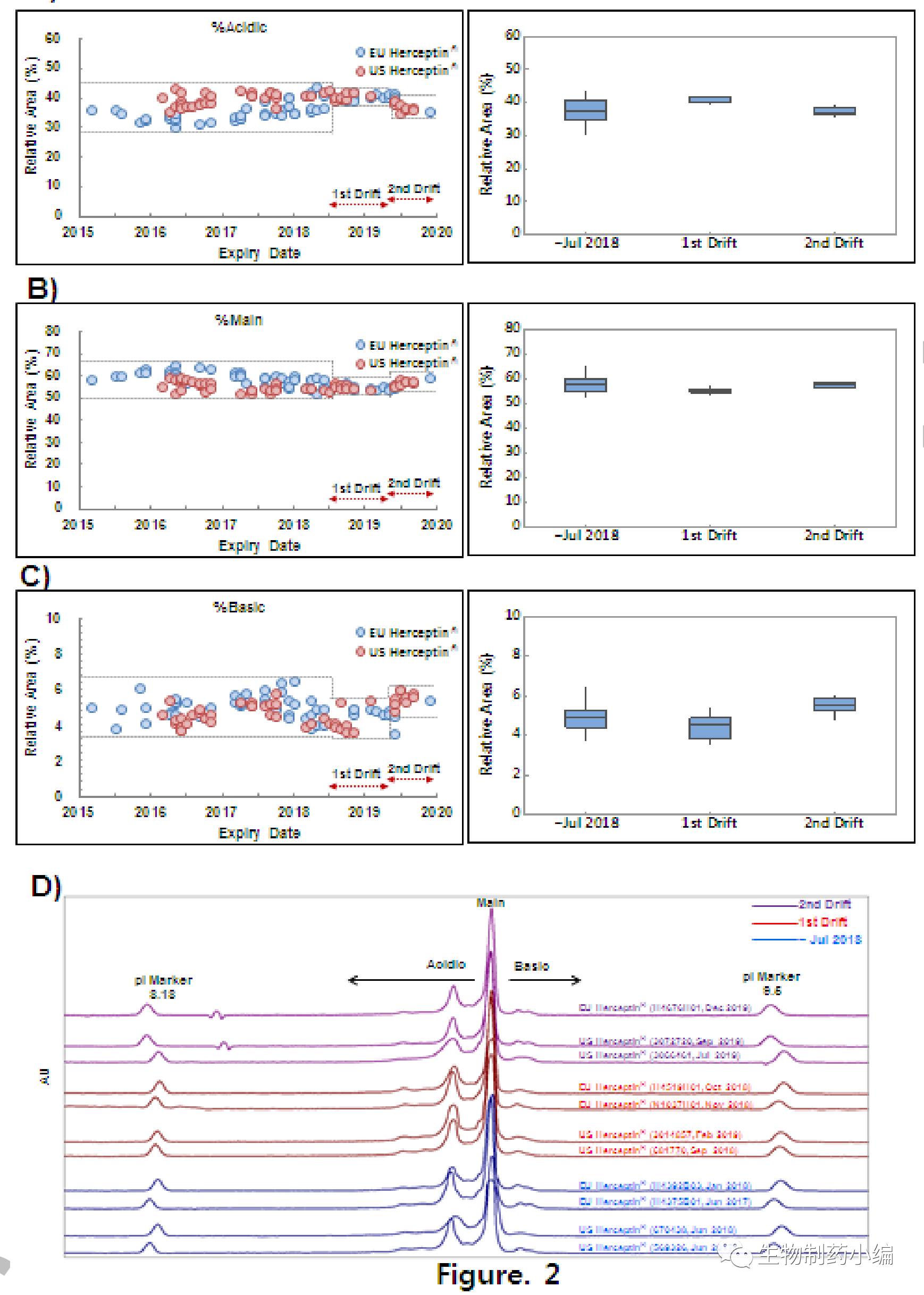 ▲ 多批次Herceptin电荷异质性数据
▲ 多批次Herceptin电荷异质性数据
在两次有关糖基化质量参数偏移过程中,分子量大小的变化也不明显。两次糖基化质量参数偏移过程,多聚体的含量似乎依次减少。
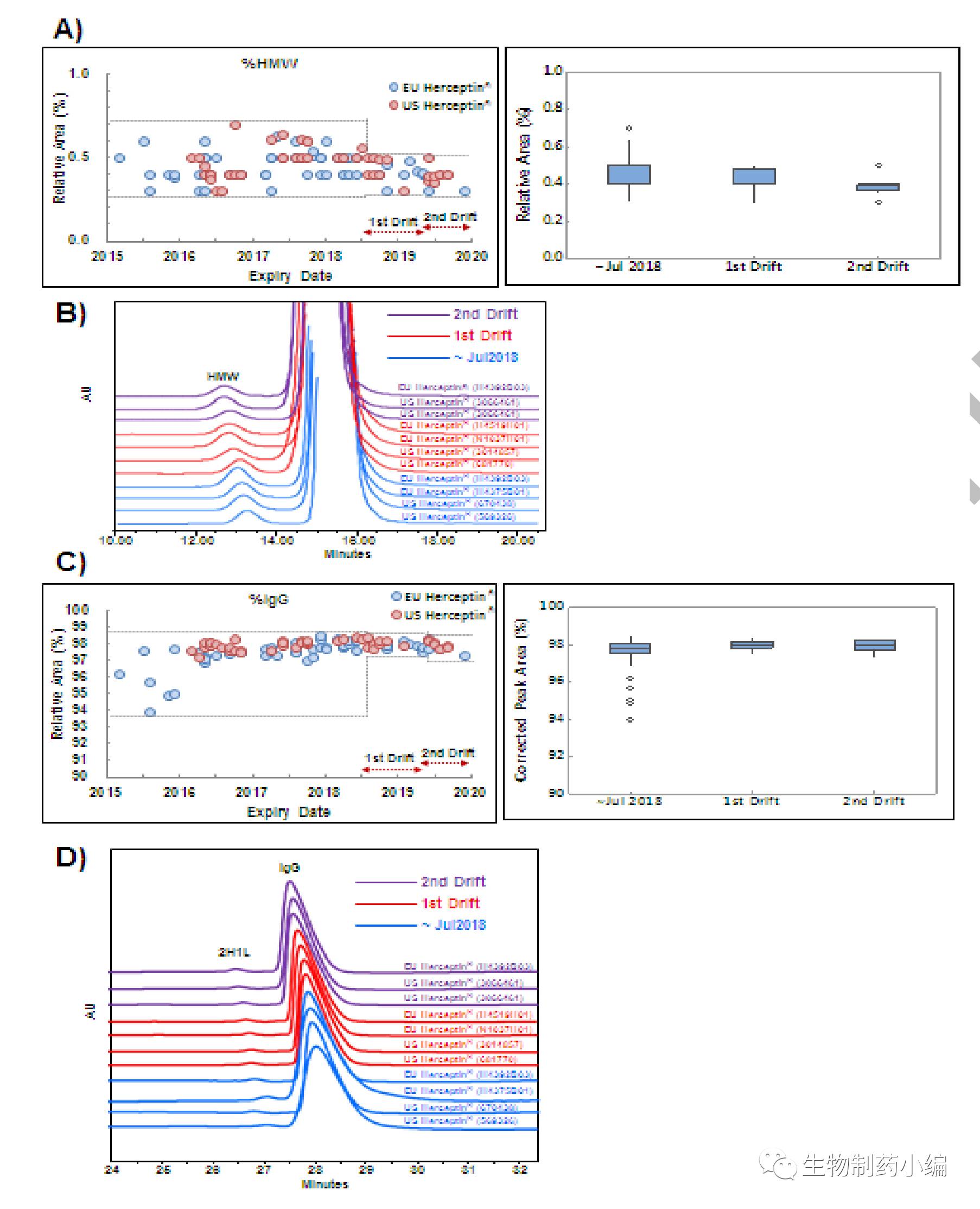
▲ 多批次Herceptin分子量大小分布
产业升级:工艺变更在路上
Herceptin的质量偏移源头
Herceptin为什么会出现质量偏移?通常这样的质量参数偏移可能来自于工艺转移、产能增加和工艺改进等引起的工艺变更,笔者进一步在EMA官网查阅Herceptin审评数据。结果显示,从2014年起,Herceptin共发生过三次原液生产的工艺变更,2014年9月和2016年2月的两次可能会对产品的质量、安全性和有效性产生显著(Significant)的影响,而2016年9月这次影响很小(minor)。而Herceptin的产品有效期为三年,这两次的工艺变更时间跟Samsung药业的发现质量偏移时机较为相符。
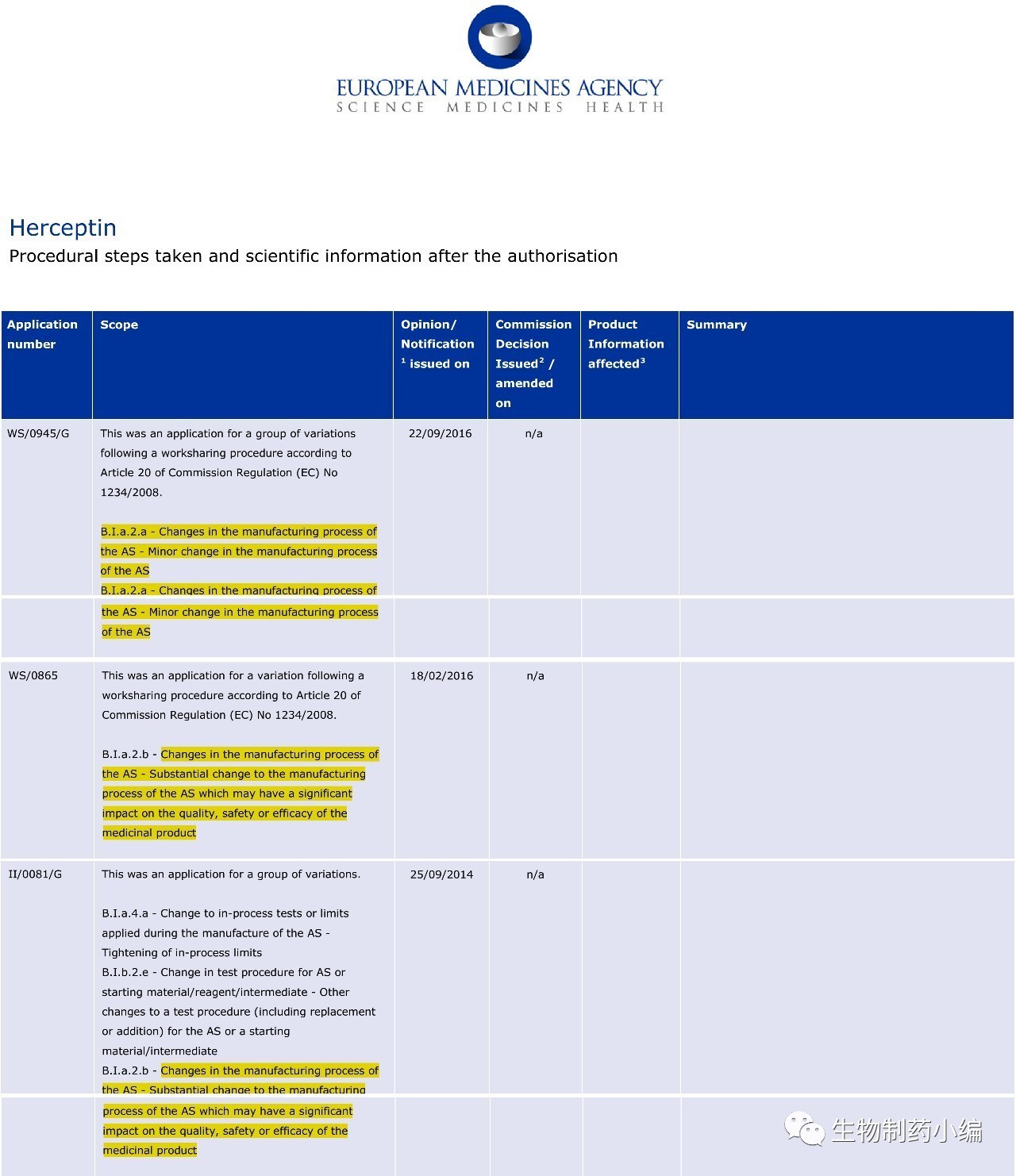
▲ Herceptin自2014年来原液工艺变更历史
充满争议的工艺变更
值得注意的是这并不是第三方公司首次检测发现原研厂家的质量参数发生偏移,仿制药巨头Sandoz 早在2011年就在Nature Biotechnology发表了对有效期从2007年到2011年的三个品种Aranesp , Rituxan和Enbrel 的全面质量分析结果,结果发现三个品种在此期间都发生了较大的质量参数偏移。
在药物的生命周期过程中,基于工艺转移、产能增加和工艺改进等引起的工艺变更不可避免,而这些变更也通常会带来产品质量参数的变化, 如果能证明这些变更没有影响到产品的有效性和安全性,监管部门通常会在不改变产品标签(Product label)的情况下批准这些变更。然而由于缺乏第三方的公开数据,致使关于工艺变更的讨论通常停留在理论层面,并且充满争议。不知道是否考虑到自身作为类似药的开发的敏感性,即使Sandoz 在发现这些原研产品的变更后,仍然很客气指出他们的研究结果,一方面使关于工艺变更的讨论从理论层面上升到特定产品层面(潜台词是监管机构都没说什么,说明人家这样的工艺变更是合理的,咱们也别操心,下次工艺变更跟着干就是了),另一方面也使公众了解到了大分子生物药物质量控制的难点(潜台词是大分子药物搞起来就是很难,这样质量参数迁移是可接受的 )。
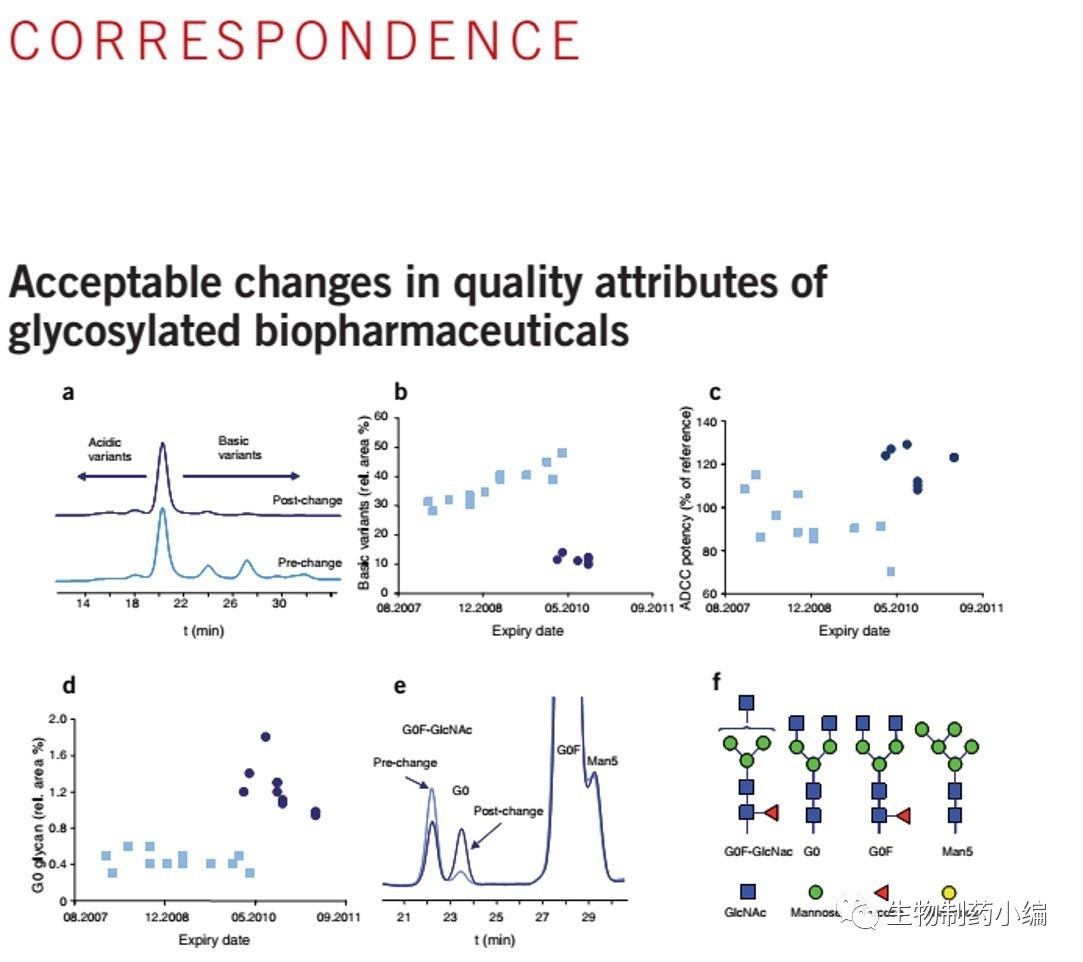
▲ 2011年Sandoz发现多批次Rituxan质量发生偏移
药王Humira工艺变更一路畅通
如前文所述,产品质量周期中,工艺变更在所难免,似乎越畅销的药工艺变更越多,至少销量都是靠扩大产能出来的。Humira 2016年的年销售额超过160亿美元,一方面自2004年来不断扩展适应症以增加标签,另一方面则来自源源不断的工艺改进、产能扩充及产品有效期延长,截止到2013年共进行了21项不同程度的生产工艺变更。然而,药王始终不改本色,保证着极为稳定的产品质量。
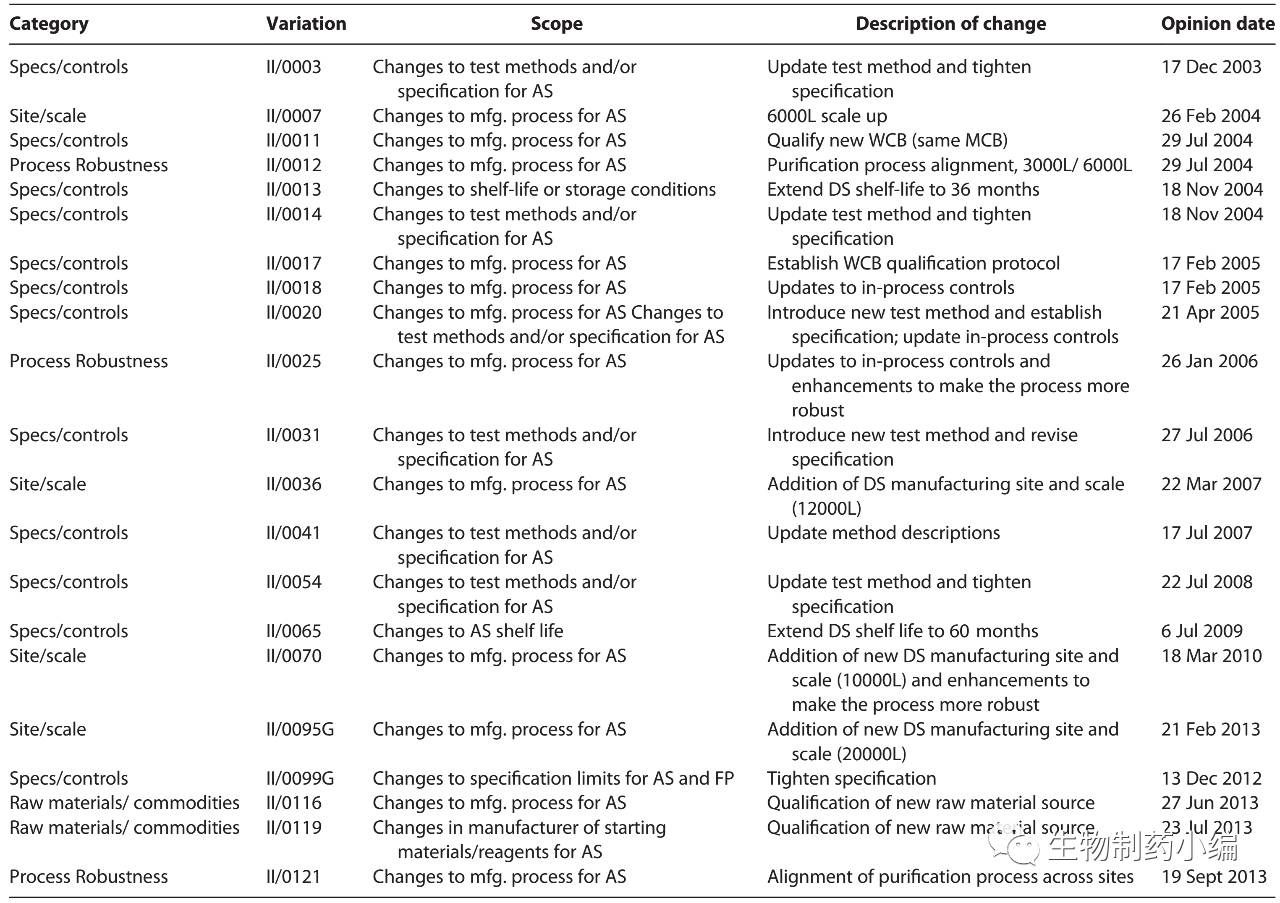
▲ Humira 工艺变更历史
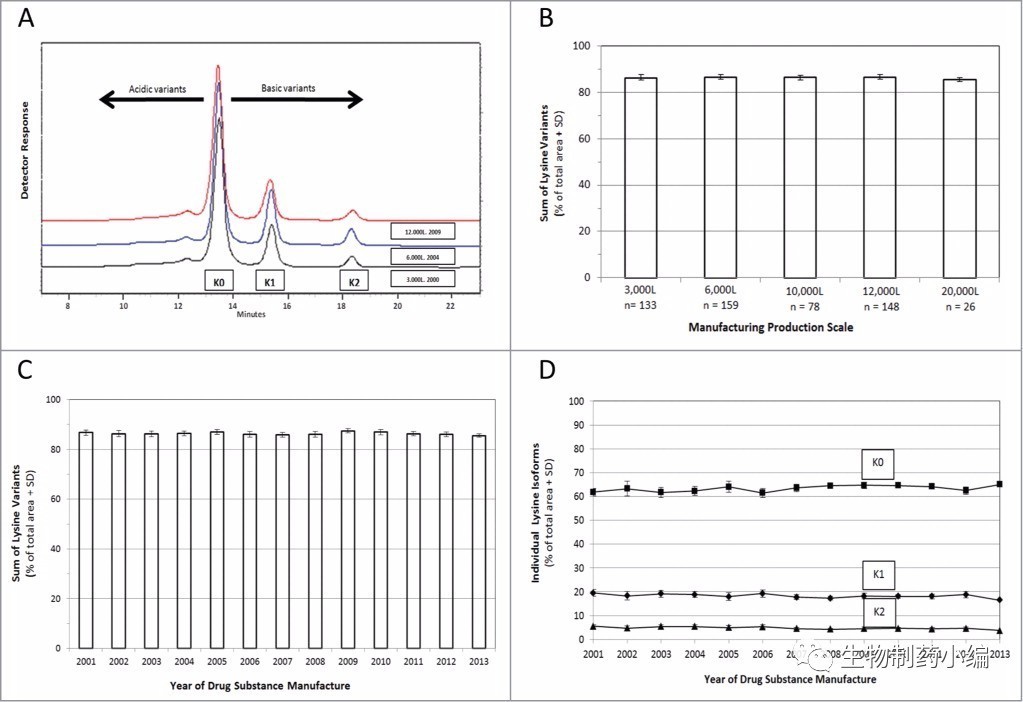
▲ Humira 工艺变更历史中质量参数
工艺变更对生物类似药开发的挑战
应对产业升级,以上如Herceptin在工艺变更情况下如此的大质量偏移是否可以接受暂且不讲,对于生物药的研发也存在诸多疑问。
1、既然原研如此大的质量参数迁移都可以接受,那么Biosimilar step-wise的相似性研究是否等于打脸?
2、没错,biosimilar的指导条例里为了规避风险,建议类似药研究者要横跨多个批次多个地区的原研药进行研究。多个批次中的原研药没有多大区别还好说,像Sandoz和Samsung这样发现原研药质量发生迁移,到底该怎样确定质量标准?更悲剧一点,如果临床前或者更早期的时候跟原研的相似性极好,到关键III期临床试验如果是因为原研工艺变更导致相似性不好又该怎么办。(通常这种情况类似药厂家很难找到原因,因为不可能把两个时间维度的原研药进行头对头对比)
3、目前基于这些研究结果,Sandoz和Samsung的口吻极其谨慎,因为如果弄不好原研厂家会封锁相关原研药的出售,而这将是所有类似药开发的噩梦。目前几个品种基于不同的策略已经有不同原研药管控。Humira的口子最大,你要多少我给你多少,早日助我彪入200亿美元大关。而据悉Infliximab已经封锁了在华对于类似药比对的销售。第三方的监测确实可以增加原研厂家的透明度,但不知道这样的透明是否会给原本敏感的原研药出售雪上加霜?
4、原研的质量偏移尚且这么大了,类似药又如何能实现Interchangable?
工艺变更的理性指导迫在眉睫
欧美工艺变更的理论条例更为完善
按照可能对产品安全性、有效性和质量可控性产生的影响程度,施行变更分类管理,是国际通行的办法,ICH Q5E是所有工艺变更的研究的基础
Ø美国FDA将变更分为三类:l重大变更l一般变更l微小变更
Ø欧盟将变更分为两类lⅠ类变更(ⅠA类微小变更、ⅠB类微小变更)lⅡ类重大变更
基于这些变更的研究者将完成特定的研究,FDA理论性较为精要,而EMA的不仅理论性更强,同时还有很多具体的案例指导。
国内理论和案例的指导均缺乏
自“7.22”以来,国内药物生产核查监管升级,经历临床数据自查和一致性评价之后,监管机构开始2016年8月11日,CFDA发文公开征求《关于开展药品生产工艺核对工作的公告(征求意见稿)》的意见。
同时指出药品生产企业应于2016年12月31日前完成上述自查、研究验证、提交备案或补充申请等相关工作;药品生产企业应于2016年12月31日前完成上述自查、研究验证、提交备案或补充申请等相关工作;未按时完成的,应暂停生产或进口。
2017年3月1日起,国家食品药品监督管理总局将组织专家对药品生产企业开展飞行检查。检查中发现实际生产工艺与食品药品监管部门备案或核准的生产工艺不一致的,其所生产的药品按假药论处,将依据《中华人民共和国药品管理法》第七十三条的有关规定进行处罚。
而相关工艺变更评估的则可依据《已上市中药变更研究技术指导原则(一)》、《已上市化学药品变更研究的技术指导原则(一)》、《生物制品生产工艺过程变更管理技术指导原则》。
而原文提到的《生物制品生产工艺过程变更管理技术指导原则》则是在2005年的发布的一则指导原则,指导原则根据变更情况,将变更内容分类六类,类型分为三种。变更引起产品内在质量发生改变的,需要按新药申报程序进行申报为I类,请参考《药品注册管理办法》附件4药品补充申请注册事项及申报资料要求;变更可能对产品的安全和有效性有影响的为II类,需报CFDA审批;一般不影响产品安全性和有效性的为III类,需报CFDA备案。
▲ 生物制品生产工艺过程变更管理技术指导原则
需要指出的是,该条例无论从时效性和指导性方面均有一定程度滞后,同时缺乏更具体的指导案例研究。近10年来,国内生物药业增速明显,产业升级加快,目前国内存在多方面的工艺变更需求,可以说工艺变更的理性指导迫在眉睫。
而值得注意的是,2014年8月举行的CFDA药品质量管理夏季研讨会上,CDE曾明确提出过生物制品CMC变更技术指导原则实施计划,并且分享过相关工艺变更的实施案例。但原定于2014底完成的指导条例至今仍未见面,是否基于其它优先级更高的事务而受搁置仍不可知。

▲ 原生物制品CMC变更技术指导原则实施计划
基于科学技术的不断进步,生产条件的持续改变,政策法规的升级,临床和市场需要的满足,生物制品的变更将贯穿于药物研发、生产和流通的整个产品周期中。质量提升无止境,工艺变更永远在路上。
参考文献
Drifts in ADCC-related quality attributes of Herceptin®: Impact on development of a trastuzumab biosimilar
Acceptable changes in quality attributes of glycosylated biopharmaceuticals
Consistency of quality attributes for the glycosylated monoclonal antibody Humira (adalimumab)
EMA:WC500049820
CFDA:生物制品生产工艺过程变更管理技术指导原则