
2017年,全球医药销售排名前二十名的药物主要涉及肿瘤和类风湿性疾病等,其中包括7个抗体药物和3个重组蛋白药物(共计10个生物药)[1]。预计2022年全球销售前十名的大部分将依旧是生物药。据Cortellis统计,截至2017年6月5日,全球范围内处于活跃研发阶段的生物药为12573个,3649种生物药物处于临床阶段,其中有809种药物处于三期临床。全球范围内近两年里可能会获得上市批准的各类生物药物近300种。生物药中处于活跃研发阶段的抗体药物共2283个,其中处于临床到上市阶段的抗体药物共810个[2]。
抗体药物市场格局及领域分布
近年来,抗体药物的研发热潮已经进入收获期,抗体新药获批呈现井喷趋势。2017年FDA共批准了10个抗体药物,抗体药物市场容量也在稳步增长。2015年抗体药物(包括融合蛋白)销售额达到906.26亿美元,2016年全年销售额为1069亿美元左右,2017年全年销售额约为1200亿美元(精确数据暂未发布完全),近三年年均增长率约为15%(数据来源,各公司报表)。截止2017年12月,已批准上市的抗体类药物已超过七十个。
抗体市场格局
抗体药物市场主要集中在Roche、Abbvie、J&J、BMS、Novartis和Amgen六大公司,2017年以上六大巨头即占据抗体药物市场近70%的市场份额[2]。Roche治疗乳腺癌等多种肿瘤的herceptin、治疗结肠癌等多种癌症的Avastin和治疗淋巴瘤等疾病的Rituxan均表现稳定,2017年三个药物总销售额达226.53亿美元,占据抗体药市场份额的17.4%(表1)。Abbvie凭借药王adalimumab长年占据药物销售排行榜榜首,2017年同比增长15%占据全球市场14%的份额。J&J凭借Infliximab、Ustekinumab、Golimumab和Daratumumab占据10.3%的市场份额。BMS引领PD-1的热潮,2017年Opdivo同比增长31%,与Abatacept、Ipilimumab共同占据6.7%的市场份额(表1)。Novartis在抗体市场的地位来自与Roche的合作,Lucentis和Xolair是其主要武器。随着IL-17抗体药物Cosentyx的上市Novartis更具竞争力,2017年Cosentyx和Lucentis两个抗体共占市场3%。此外,Amgen凭借三个融合蛋白(Enbrel、Neulasta和Aranesp)和两个单抗药物(Prolia与Xgeva)占据全球市场的12%。随着在抗肿瘤领域、自身免疫领域、抗感染领域、精神疾病领域等新抗体药物获批,抗体药物市场将更加多样化,竞争也将更加复杂。

抗体领域分布
从发展历史看,抗体药物最重要的应用领域为自身免疫病和抗肿瘤领域,2017年,治疗自身免疫病和癌症的抗体药物合计占到了65%的抗体市场份额[2]。随着疾病机制的深入研究,抗体药物在哮喘、抗感染、血液病和心血管病领域的药物不断增加,并迅速拓展到骨质疏松、多发性硬化症、阿尔茨海默病等诸多领域,未来这些抗体新药的陆续上市,将极大改变目前较为单一的市场格局,反过来也将影响企业的抗体药物研发布局[4]。就数量适应症而言,治疗肿瘤类的抗体药物30个,自身免疫性疾病的抗体药物28个,哮喘类药物4个,感染性疾病5个(RSV以及储备用的炭疽抗体),高脂血症2个,血液病3个,其他适应症抗体药5个(如绝经后妇女骨质疏松症/骨伤预防,移植排斥反应等)(表2,数据来源于FDA网站)。

抗体技术分析
抗体药物的人源化程度、亚型、表达载体也是关注的重点
抗体人源化进程
就人源化程度而言,在现有上市的单抗产品中(不包含8个融合蛋白),全人源单抗25个,人源化单抗31个,嵌合单抗9个,鼠源5个;占比分别为32.1%、39.7%、12%和6.4%。自1975年单克隆抗体杂交技术问世以来,鼠源抗体被誉为神奇的子弹,1986年第一个鼠源抗体Orthoclone OKT3® (Muromonab-CD3)的上市开启了抗体的新时代。至今为止,FDA批准上市的鼠源抗体共4个,分别是OrthocloneOKT3® (Muromonab-CD3)、Zevalin® (Ibritumomab tiuxetan)、Panorex® (Edrecolomab)和Bexxar® (Tositumomab-I131)。然而鼠源单抗作为异源性蛋白在人体内会引起强烈的人抗小鼠抗体(HAMA)免疫反应,严重影响治疗效果甚至危机生命。为解决这一难题,抗体的发展经历了如下历程:恒定区人源化(嵌合抗体)→可变区人源化抗体→全人源抗体。
嵌合抗体技术的使用主要集中在十年前,2010年以后FDA批准上市的嵌合抗体共4个,分别是ADCETRIS® (Brentuximab vedotin)、Sylvant® (Siltuximab)、 Unituxin® (dinutuximab)和Anthim®(obiltoxaximab)。目前FDA批准上市的抗体主要以人源化和全人源为主,自1997年第一个人源化抗体Zenapax® (Daclizumab)上市以来,目前共31个人源化抗体上市,近五年批准上市的抗体中40%的抗体为人源化。
在全球单抗市场中全人源单抗是未来的发展方向,FDA批准上市的78个单抗中有25个是全人源单抗,主要集中在近九年内。第一个批准上市的全人源单抗是阿达木单抗,至2012年起连续6年占据全球药物销售排行榜榜首,成为最畅销的药王。随着转基因小鼠和噬菌体展示技术的成功应用,全人源化克隆单抗的比重将逐步增大。
抗体亚型
在抗体药物中IgG有4个亚型,不同的结构特点及功能特点使其治疗应用上有较大区别,需要ADCC和CDC效应作用的抗体优先选择IgG1亚型。IgG1亚型是现在最成熟的、研究最多的,现有上市单抗药物78%为人IgG1型,共61个(图1)。IgG4和IgG2与IgG1一样有着很强的FcRn亲和力和半衰期,同时具有很弱的ADCC活性和CDC活性(IgG4无CDC活性)。如果只是阻断抗体,不需要ADCC和CDC效应,优先选择IgG4。
IgG4亚型在近几年应用也慢慢增多,目前上市的抗体药物中有10个药物(图1)为IgG4亚型,例如免疫检验点抑制剂PD-1抗体Keytruda®(pembrolizumab)和Opdivo® (nivolumab)。也有部分的抗体采用IgG2亚型(主要也是低ADCC和CDC效用),相比于IgG4亚型的抗体IgG2亚型成药的几乎寥寥无几。主要因为IgG2的二硫键错配问题,IgG2的二硫键远比IgG1和IgG4的复杂[3-5]。IgG3由于其半衰期比较短并且hinge区域易水解,限制其在药物中应用,目前上市的药物中暂无该亚型。
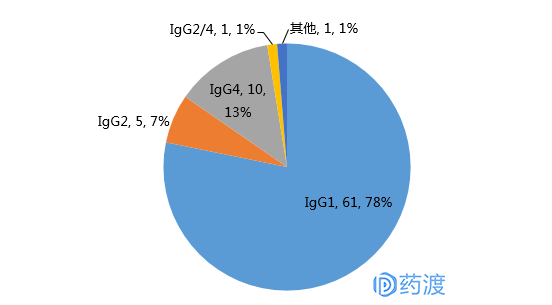
图1 抗体药物亚型统计(数据来源于FDA)
抗体表达细胞系
就表达载体而言,目前市面上的单克隆抗体大多是由哺乳动物细胞表达,主要是CHO、Sp2/0、NS0等。不同的表达载体具有不同的特性,CHO细胞表达载体遗传背景清晰,产业化应用广泛,现有上市的抗体药物中有46个(59%))采用CHO细胞(表3[7]),Fc融合蛋白100%都是CHO细胞表达。此外,有7个抗体采用Sp2/0细胞系,14个抗体采用NS0细胞系,3个抗体采用E.coli表达,5个抗体采用鼠杂交瘤技术表达,各种表达体系优缺点[6]见表3。由此可见CHO始终是抗体药物表达的主流载体,占到所有已上市抗体药物的一半。

已上市抗体靶点分析
截止2017年12月,目前批准上市的抗体类药物共78个(不含仿制药),包含8个融合蛋白和70个抗体,主要针对48种不同靶标。其中靶点为CD20的药物有6个,抗肿瘤坏死因子α (TNFα)和程序性死亡受体-1 (PD-1/L1)各有5个,血管内皮生长因子(VEGF /VEGFR) 和表皮生长因子受体(EGFR)各4个;、IL17、IL6R、IL5和抗人表皮生长因子2(HER2)各有3个;PSK9、白介素1 (IL-1)、α4/β1/7整合素、CD80和炭疽PA抗原的各2个。其余靶标(VEGFR2、、CD52、B淋巴细胞刺激因子(BLyS)、C5补体、趋化因子受体4 (CCR4)、CD6、CD25、CD30、CD38、细胞毒性T淋巴细胞相关抗原4 (CTLA-4/CD152)、双唾液酸神经节苷脂(GD2)、血小板糖蛋白GPIIb/IIIa、IgE、IL12 /23、细胞核因子κB受体活化因子配体(RANK-L)、RSV病毒F蛋白A抗原、信号淋巴细胞激活分子7 (SLAMF7)、达比加群酯,以及抗CD19/CD3和抗EpCAM/CD3双特异靶标的产品各1个(表4)。目前,2017年的具体销售数据暂未统计完全,我们从2016年的销售数据分析销售前十的靶点分别是:TNFα (387亿)、VEGF (153亿)、HER2 (95.0亿)、CD20 (75亿)、PD-1 (60亿)、IL12/23 (32.3亿)、RANK (31.6亿)、C5补体(28亿)、EGFR (24亿)、IgE (23亿)。这是个靶点的销售额占抗体销售总额的85%,其中TNFα占36%(表4,数据来源于[8])。

下面根据不同领域中不同靶点介绍一些热门的单抗药物
2.1 抗肿瘤领域 [9]
目前抗肿瘤领域有30个抗体类药物上市,涉及靶点共18个。下面根据单克隆抗体作用特点,通过抑制肿瘤生存的关键分子、抗体偶联细胞毒药物和靶向免疫抑制(激活)分子几个方面介绍已上市的单克隆抗体在肿瘤治疗领域的应用。
2.1.1抑制肿瘤生存的关键分子
(1) CD20
B淋巴细胞表面标志物CD20初始表达于Pro-B细胞(CD45R+,CD117+),随着B细胞的成熟表达不断增加。CD20在分化成熟的浆细胞、正常造血干细胞及其他类型造血细胞系均无表达。因此,CD20成为治疗B淋巴细胞白血病的分子药靶。代表药物:Rituximab (Rituxan)、Ibritumomab Tiuxetan (Zevalin)、Ofatumumab (Arzerra)、Obinutuzumab (Gazyva)、Ocrelizumab (Ocrevus)
(2) HER2
HER2是一种具有酪氨酸激酶活性的跨膜糖蛋白,属于表皮生长因子受体(HER)家族成员之一。HER家族包括HER1 (erbB1,EGFR)、HER2 (erbB2,NEU)、HER3 (erbB3)及HER4 (erbB4)。HER家族成员在细胞生理过程中发挥重要调节作用,通常经配体结合或相互之间形成二聚体介导信号转导。研究发现,HER2不仅与肿瘤的发生发展密切相关,同时也可作为重要的乳腺癌预后判定指标。靶向HER2的单克隆抗体能够下调HER2表达水平并抑制肿瘤生长。代表药物:Trastuzumab (Herceptin)、Pertuzumab (Perjeta)
(3) VEGF/VEGFR2
血管内皮生长因子(VEGF)在诱导血管发生和生成、增强血管渗透性、内皮细胞生长、促进细胞迁移及抑制细胞凋亡等方面发挥关键作用。因此,VEGF及其受体VEGFR2成为肿瘤治疗的药物靶点。代表药物:Bevacizumab (Avastin)、Ramucirumab (Cyramza)
(4) EGFR
EGFR (HER1,cErbB-1)属于HER家族。EGFR不仅调节人体正常细胞生长,肿瘤发生后也促进肿瘤细胞增殖。表皮生长因子(EGF)和转化生长因子α (TGF-α)活化膜受体EGFR酪氨酸激酶,促进EGFR构象变化形成二聚体,激活下游信号包括Ras、Raf和PI3K-AKT等。临床研究发现,通过抗体阻断EGFR可以抑制直肠癌等肿瘤细胞通过上述信号通路引发的血管再生、肿瘤转移及耐药。代表药物:Cetuximab (Erbitux)、Panitumumab (Vectibix)、Ranibizumab (Lucentis)。
(5)其他抗肿瘤抗体靶点
CD19、CD21和CD81均为B淋巴细胞特异表面标志,常被用作B淋巴细胞白血病的诊断标志。CD19代表药物:Blinatumomab (Blincyto)
CD25是由IL2RA基因编码的IL-2受体α链。CD25在大多数B淋巴细胞瘤、部分急性非淋巴细胞白血病、神经母细胞瘤、肥大细胞增多症以及肿瘤浸润性淋巴细胞中表达,能够作为Ⅰ型人类T淋巴细胞白血病病毒受体发挥作用。代表药物:Daclizumab (Zenapax)
膜蛋白SLAMF7属于信号淋巴细胞激活分子家族成员,最早研究发现其参与天然杀伤细胞(NK细胞)黏附功能。2008年的一项研究发现多发性骨髓瘤患者浆细胞高表达SLAMF7。代表药物:Elotuzumab (Empliciti)
多种免疫细胞包括CD4+T细胞、CD8+T细胞、B细胞和NK细胞表达膜糖蛋白CD38。CD38在细胞黏附和钙信号转导作用中发挥关键作用。CD38分子是慢性B淋巴细胞白血病的预测因子,也是自身免疫反应性糖尿病的诊断指标,同时还可用于艾滋病和巨细胞病毒的检测及系统性红斑狼疮的病情监测。代表药物:Daratumumab (Darzalex)。
2.1.2 抗体偶联细胞毒药物 (ADCs)
ADCs (antibody-drug conjugate)是一类将化疗药物与抗体偶联的药物,能够杀死肿瘤细胞,并且不良反应较少。Emtansine (DM1) 以及MMAE是常用的两种偶联化疗药物。代表药物:曲妥珠单抗(赫赛汀)偶联细胞毒性剂DM1靶向HER2的抗体偶联药物——ado-trastuzumab emtansine (Kadcyla)、偶联抗CD30抗体和MMAE的药物——Brentuximab vedotin (Adcetris)。
2.1.3靶向免疫检查点
(1) CTLA-4(靶向免疫抑制分子)
白细胞分化抗原细胞毒T淋巴细胞相关抗原4 (CTLA-4)是一种T细胞跨膜受体。CTLA-4与其配基B7分子结合后抑制T细胞免疫活性,诱导免疫耐受的形成。代表药物:Ipilimumab (Yervoy)
(2) PD-1/L1(靶向免疫抑制分子)
PD1属于免疫球蛋白超家族的细胞膜受体,主要表达于T细胞及B细胞。PD-1受体存在PD-L1和PD-L2两种配基。PD-1活化T细胞,与其配基结合抑制T细胞活性。PD-1/L1抑制性免疫信号通过促进淋巴结抗原特异性T细胞凋亡和减少调节性T细胞凋亡实现。代表药物:pembrolizumab (Keytruda)、nivolumab (Opdivo)、atezolizumab (Tecentriq)、Avelumab (Bavencio)、Durvalumab (Imfinzi)。
(3) CD137/OX40(靶向免疫激活分子)
CD137/OX40主要表达在活化T细胞及炎症反应过程的树突细胞、B细胞、滤泡树突细胞、NK细胞、粒细胞及血管壁细胞。CD137在调节肿瘤免疫及T细胞活化、增殖、黏附等方面发挥关键作用。代表药物:utomilumab
2.2 风湿类免疫疾病领域[9]
近年来,抗风湿类疾病依旧在市场占有中名列前茅,并有了超过糖尿病领域越身第二大疾病领域的趋势。TNF-α抗体是迄今最为成功的药物靶点,此外还有多个涉及调节炎症性反应的细胞因子靶点,如IL-1、IL-5、IL-6/L-6R、IL-12、IL-17A、IL-23、BCMA等。补体系统同样发挥重要作用,如在系统性红斑狼疮、特应性皮炎等疾病进展中发挥作用。目前已有32种风湿类免疫疾病抗体类药物上市,TNFα为靶点的药物占有5个。
(1)TNF-α
TNF-α是急性炎症反应期释放的细胞因子,主要通过活化单核巨噬细胞分泌,在炎症反应调节和细胞存活过程中发挥关键作用。适量TNF-α有助于肿瘤预防和病原菌抵抗,然而过量TNF-α可能造成多种病理损伤并促进肿瘤发生发展。代表药物:Infliximab (Remicade)、Adalimumab (Humira)、Certolizumab pegol (Cimzia)、Golimumab (Simponi)
(2) IL-6及IL-6R
多功能细胞因子白细胞介素6(IL-6)具备促进和抑制炎症反应的双重作用,在多种疾病发生发展过程中发挥关键作用。代表药物:tocilizumab (Actemra)、Siltuximab (Sylvant)和Sarilumab
(3) RANKL
Ⅱ型膜蛋白RANKL属于肿瘤坏死因子超家族成员,在骨骼肌、胸腺、肝、结肠、小肠、肾上腺、成骨细胞、乳腺上皮细胞、前列腺及胰腺均有表达。RANKL参与凋亡,同时能够通过免疫系统调控骨再生及重塑。代表药物:Denosumab (Prolia)
(4) IL-12/IL-23
细胞因子IL-12在Th1型细胞介导的炎性免疫反应中发挥关键作用。自身免疫性疾病斑块型银屑病主要表现为炎症斑块和鳞屑状皮肤,伴随IL-12和IL-23等细胞因子异常增高。代表药物:Ustekinumab (Stelara)、Guselkumab
(5) IL-1β
IL-1β调节炎症免疫反应,过度活化的IL-1β也会引起免疫系统疾病。代表药物:canakinumab (Ilaris)
(6) IL-5
细胞因子IL-5调节嗜酸性粒细胞的生长、活化和存活。IL-5在嗜酸性粒细胞从骨髓迁移至肺部及其他器官时发挥关键作用。代表药物: mepolizumab (Nucala)、reslizumab (Cinqair)和benralizumab
(7) α4β7
整合素是淋巴细胞的肠道迁移关键蛋白,在肠道疾病的发生发展过程中发挥关键作用。代表药物:Vedolizumab (Entyvio)
(8) BAFFB
细胞激活因子(BAFF)在维持B细胞发育和存活过程中发挥关键作用。研究发现,自身免疫性疾病系统性红斑狼疮(SLE)发生过程中BAFF表达异常增高,引起自身免疫性B细胞异常增殖,进而促进SLE发展。代表药物:belimumab (Benlysta)
(9)抗IL-17A治疗炎性相关疾病
细胞因子IL-17A主要通过T细胞产生,与其受体IL-17RA、IL-17RF结合后刺激纤维细胞、胆道上皮细胞释放IL-1、IL-6、TNF-α以及CXCL1等促炎因子,最终导致类风湿性关节炎、牛皮癣和多发性硬化等慢性炎性疾病。代表药物: secukinumab (Cosentyx)、Ixekizumab (Talz)、brodalumab (Siliq)
2.3 其他
(1)炭疽毒素保护抗原(PA)代表药物: raxibacumab、 Obiltoxaximab (Anthim)
(2)达比加群酯(diabigatran)代表药物:idarucizumab (Praxbind)
(3)PCSK9代表药物:alirocumab (Praluent)与evolocumab (Repatha)
(4) IgE代表药物:Omalizumab (Xolair)
总结
从抗体技术上分析,近年来上市的抗体逐渐从人源化向全人源发展;IgG亚型的选择多为IgG1型,IgG4型的抗体也逐渐增多;在抗体表达载体的选择上,大多数抗体选用动物细胞系,CHO细胞依旧是主流。从靶点细分上看,上市的抗体主要集中在抗肿瘤和自身免疫性疾病领域。截至2017年5月,全球共有70个抗体类药物进入三期临床阶段,还有575个抗体类药物进入第一阶段或第二阶段临床试验[10]。在研的肿瘤领域和自身免疫领域靶点研究主要集中在CD19/ HER2、CD20/IL17等,此外神经、代谢和心血管领域也有一些热门在研靶点,如CD3E、APP。
参考文献
[1] 2017年全球药物销售额TOP100|排行榜.
https://baijiahao.baidu.com/s?id=1593924051378350770&wfr=spider&for=pc
[2] Clarivate analytics, 全球抗体药物研发进展对中国的启示.
[3] J Wypych et al. HumanIgG2 Antibodies Display Disulfide-mediated Structural Isoforms. Journal of Biological Chemistry. 2008, 283 (23): 16194-205
[4] B Zhang, AG Harder et al. Determination of Fab-hinge disulfide connectivity in structural isoforms of a recombinant human immunoglobulin G2 antibody. Analytical Chemistry, 2010, 82(3):1090-1099
[5] T Ito,K Tsumoto. Effects of subclass change on the structural stability of chimeric, humanized, and human antibodies under thermal stress. Protein Science, 2013, 22 (11):1542-1551
[6] 刘伯宁. 用于重组抗体生产的细胞构建技术研究进展. 中国生物工程杂志, 2013, 33(6):111-116
[7] M Chartrain,L Chu. developmen and production of commercial therapeutic monoclonal antibodies in mammalian cell expression system: an overview of the current upstream technologies. Current Pharmaceutical Biotechnology, 2008 , 9 (6) :447-67
[8] EvaluatePharma. World Preview 2016, Outlook to 2022.
[9] 克隆抗体研发全景概述. https://weibo.com/ttarticle/p/show?id=2309404140256864639 284.
[10] Strohl, W.R. Current progress in innovative engineered antibodies. Protein Cell (2018)9:86-120.