
25个国产PD-1/PD-L1抗体申报临床
近年来,肿瘤免疫领域发展迅速,PD-1/PD-L1抗体是其中最为耀眼的新星。截至2017年底,FDA共批准5个PD-1/PD-L1抗体,包括2个PD-1抗体和3个PD-L1抗体,在2017年,合计实现销售额达100.35亿美元。这距离首个PD-1抗体Opdivo上市仅仅过去四年。

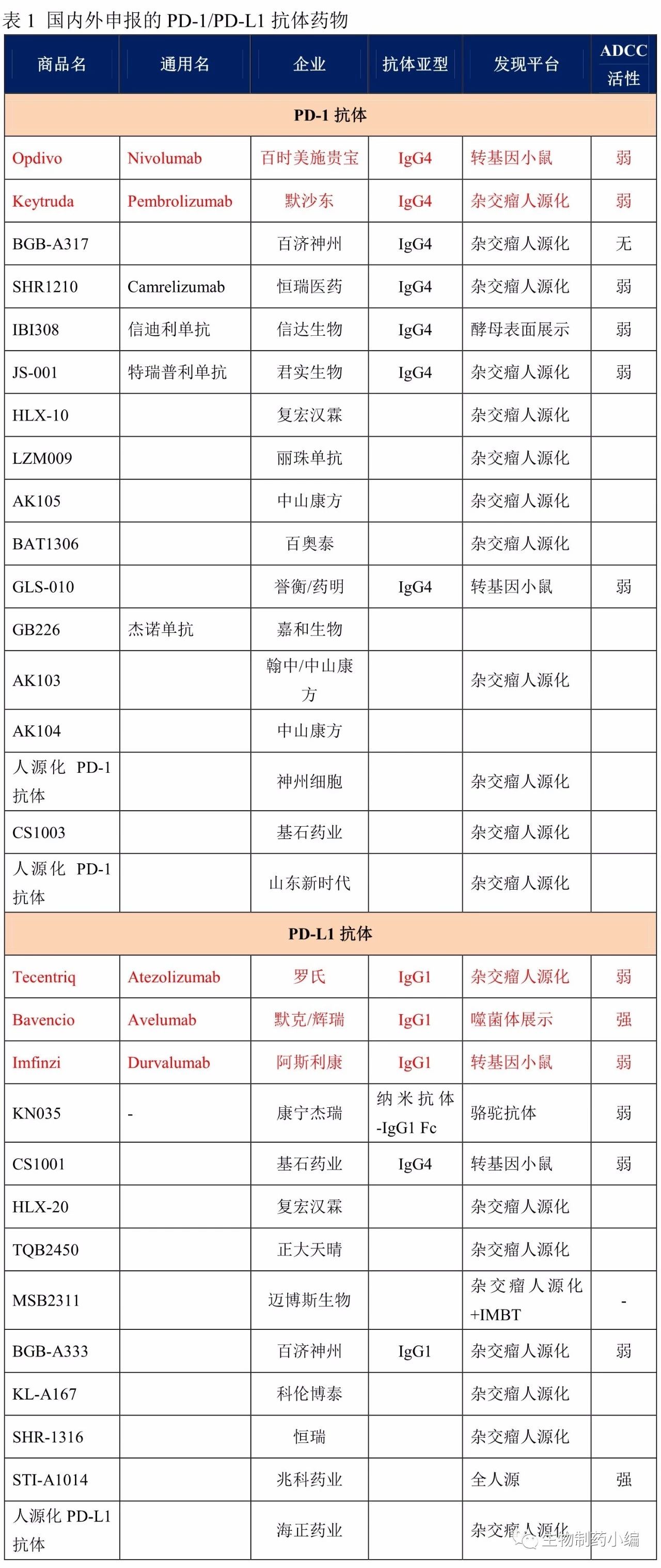
在国外PD-1/PD-L1抗体创造了一个又一个里程碑的同时,国内药企也在抓紧进行跟踪研发。截至目前,国内共申报25款PD-1/PD-L1抗体药物,包括14款PD-1抗体药物、10款PD-L1抗体药和1款PD-1/CTLA-4双特异性抗体药物。
国产PD-1/PD-L1抗体竞争格局
恒瑞、百济神州、复宏汉霖、中山康方同时申报了PD-1/PD-L1抗体。中山康方有2款PD-1药物,其中一款授权给翰中生物。
药明生物开发了至少3款PD-1抗体和1款PD-L1抗体药物。药明生物人源化PD-1抗体授权给智翔医药(根据专利发明人判断,尚未申报临床);引进转基因鼠技术平台以后,开发了全人源的PD-1抗体和PD-L1抗体,分别授权给誉衡和基石药业。基石药业也同时申报了自主知识产权的人源化PD-1抗体,根据专利发明人判断仍为药明生物开发。
李氏大药厂子公司兆科药业申报的PD-L1抗体STI-A1014,来自Sorrento,现研发代码为ZKAB001。此外,Sorrento同事开发了PD-1抗体STI-A1110,授权给施维雅。
从技术角度来看,国内PD-1、PD-L1抗体以重复开发为主,即通过杂交瘤筛选并人源化。但在这些企业中,也不乏一些差异化创新的努力。由于缺少前期基础,全人源抗体基本依靠国外的技术引进,如药明生物引进OMT转基因技术平台、兆科药业引进Sorrento全人源PD-L1抗体、信达生物引进Adimab的酵母展示技术开发的全人源抗体IBI308。除此之外,基本为人源化抗体。百济神州的创新点在于通过Fc工程化改造以弱化ADCC作用,改造技术源于既有技术的整合;迈博斯技术的创新点在于其免疫耐受破除技术,获得新表位的PD-L1抗体,同时具有pH依赖性的结合特点;康宁杰瑞的技术创新点在于采用了纳米抗体-Fc融合蛋白,可以制成常温下稳定的制剂。
临床开发紧锣密鼓
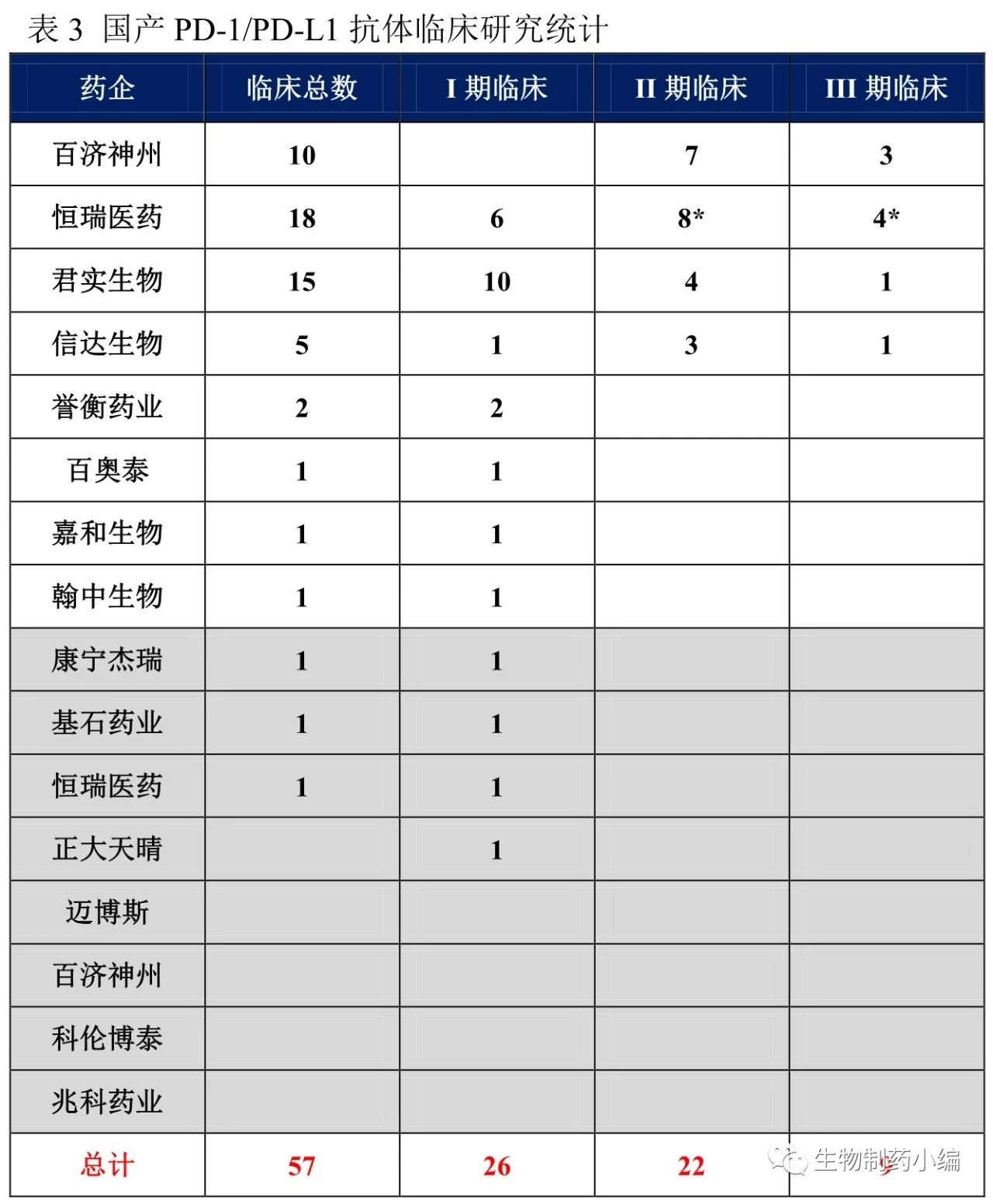
根据药物临床试验登记与信息公示平台,19个申报临床的PD-1/PD-L1抗体,已经有12个进入临床研究,共涉及11家药企、12个PD-1/PD-L1抗体药物、57项临床研究,覆盖约7000名癌症患者。
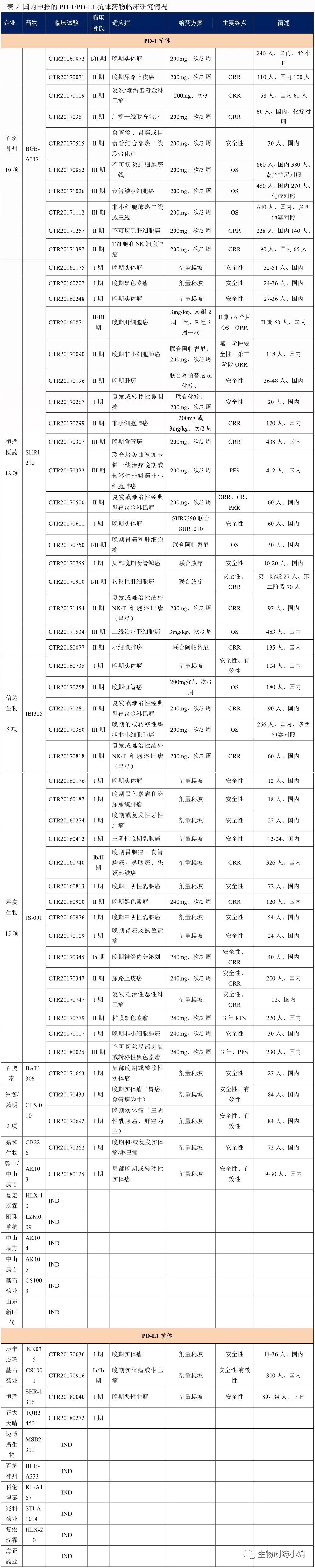
从临床研究情况来看,百济神州、恒瑞医药、君实生物、信达生物均已经开展Ⅲ期临床试验,成为该领域的第一梯队;誉衡药业、百奥泰、嘉和生物、翰中生物、康宁杰瑞、基石药业处于Ⅰ期临床研究阶段。
第一梯队中也有快慢之别,百济神州、恒瑞医药的Ⅲ期临床研究已覆盖肝癌、非小细胞肺癌、食管癌,Ⅱ期临床研究覆盖范围更广。君实生物仅有一项黑色素瘤Ⅲ期临床研究在进行中,信达生物则在进行非小细胞肺癌的Ⅲ期临床研究。第一梯队中君实生物、信达生物、恒瑞医药已经陆续申报上市,并进入优先审评。
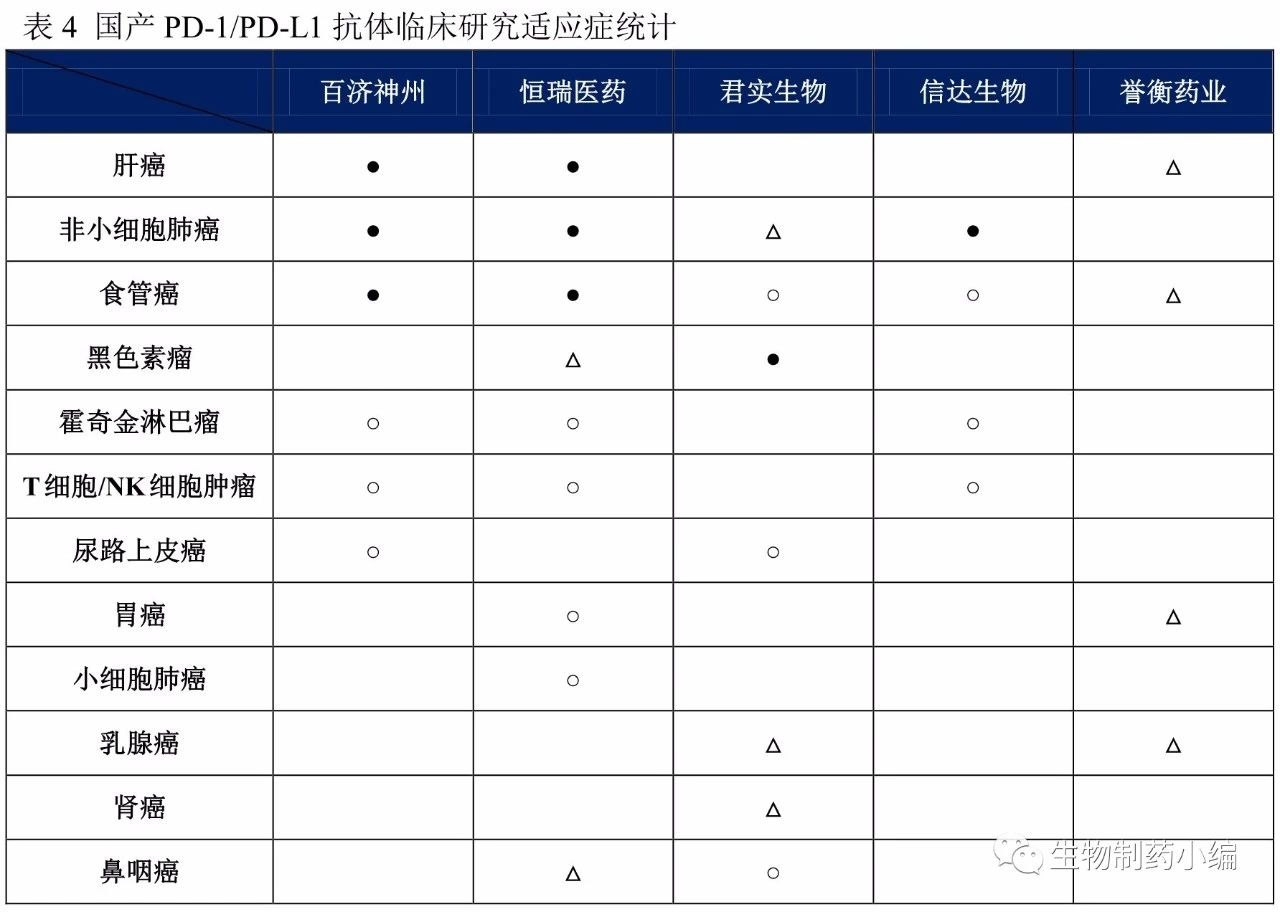
从适应症选择上看,研发整体上倾向于国内发病率较高的癌种,如肝癌、肺癌、食管癌等。黑色素瘤是PD-1抗体国外获批的首个适应症,但由于国内发病率较低,针对该适应症的临床研究并不多。值得注意的是,恒瑞医药大力推进PD-1抗体与其小分子抗癌新药阿帕替尼(商品名艾坦)的联合治疗,并力求攻克一些难治癌症,如小细胞肺癌。信达生物此前根据霍奇金淋巴瘤Ⅱ期临床研究数据申报上市,成为首个申报上市的国产PD-1抗体。不过随着药审中心发布进一步规范PD-1/PD-L1抗体的临床研究基本要求后,信达生物已经撤回该上市申请。
国产PD-1/PD-L1抗体申请FDA临床
在国内激烈竞争的格局中,一些具有差异化特色的PD-1/PD-L1抗体已经敲开了FDA的大门,尝试走向发达国家市场。康宁杰瑞/思路迪的KN035、百济神州的BGB-A317、恒瑞的SHR-1316、复宏汉霖的HLX-10、丽珠单抗的LZM-009、君实生物的JS001和迈博斯的MSB2311、信达生物的信迪利单抗(获准直接进入II/III期)等8款PD-1/PD-L1抗体已经先后向FDA递交新药临床试验(IND)申请。
总 结
近年来,国内PD-1/PD-L1抗体研究异常火热,据估计,参与竞争的药企超过百家,申报临床的接近20家。随着竞争日趋激烈,产品差异化、适应症选择、联合治疗、外部合作等,该领域已经进入全面竞争的时代。想要脱颖而出,必须要使用差异化战略。如在技术上,百济神州、康宁杰瑞、迈博斯通过不同技术平台寻求产品差异化设计;在产品运营上,百济神州与新基合作,完善国内肿瘤产品线;恒瑞则依靠自身强大的肿瘤产品线,积极展开联合治疗等。需要一提的是,恒瑞PD-1抗体具有血管瘤副作用,极大影响“颜值”。不过对于处于第一梯队的恒瑞来说,获批应该问题不大,但副作用会影响其竞争力,突破点则是通过与阿帕替尼等联合疗法,攻克一些难治瘤种,如小细胞肺癌等以取得细分市场优势。
PD-1/PD-L1的火热,为无数肿瘤患者带来新的治疗选择,为药企带来巨大机会的同时,也带来巨大的挑战。欧美在PD-1/PD-L1抗体领域走在前面,积累了许多经验。如PD-L1伴随诊断,PD-1抗体/CTLA4抗体、PD-1抗体/新型IL-2(NKTR-214)等联合治疗,剂型优化如Opdivo两周一次改为四周一次等尝试,完善和拓展了PD-1/PD-L1抗体的应用。国内众多PD-1/PD-L1抗体的陆续上市,将大幅降低价格,提高PD-1/PD-L1 抗体药物的可及性。如今PD-1/PD-L1仍处于上市应用的前夜,期待上述药物能陆续上市造福患者。
PD-1/PD-L1火热背后的过度重复开发也是不争的事实,国内药企的靶点布局需要更多差异化和创新。尽管现阶段跟踪开发是必由之路,但涌现个别具有原创精神的药企则昭示未来的趋势。如鸿运华宁十年如一日专注GPCR抗体的开发等(前点击阅读针对GPCR靶点的抗体药物研发),这样专注、深耕的药企在未来会越来越多,为中国生物医药的繁荣和发展带来更多源动力。
PD-1,不是终点;中国生物医药,依旧在路上。
参考资料