
1
Immunocore宣布开展ImmTAC®治疗实体瘤I期临床研究
8月20日,美国,Immunocore公司今日宣布其在研新药ImmTAC®用于实体瘤治疗的I期临床研究已经有第一位患者受试给药。这是Immunocore公司与GSK合作进行临床开发的第一个项目,项目开发的目的是评估免疫球蛋白分子IMCnyeso在非小细胞肺癌、膀胱癌、黑色素瘤和滑膜肉瘤患者中的安全性和耐受性,根据2013年达成的合作条款,这项研究的正式启动触发了一项程碑式的付款。
Immunocore公司专有TCR技术产生了一类新的双特异性免疫球蛋白,成为免疫动员抗癌症单克隆TCR分子。ImmTAC分子基于合成的可溶性TCRs,能够以超高亲和力识别细胞内癌症抗原,并通过抗CD3免疫重定向效应功能选择性杀死癌细胞。ImmTAC分子可以获得比典型的基于抗体的方法(包括单克隆抗体)多九倍的靶抗原。
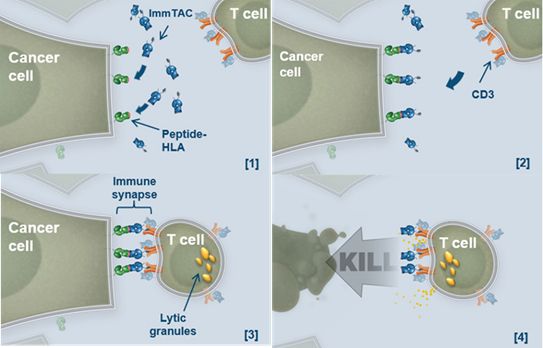
ImmTAC分子作用机制图
2
北海康成与Boehringer Ingelheim共同推进肿瘤抑制性抗体新药的临床研究
8月20日,中国,北海康成公司今日宣布,已经获得CFDA的临床试验申请批准,将开展候选药物CAN017治疗肿瘤的临床试验。CAN017是一种用于治疗食管鳞状细胞癌(ESCC)的抑制性抗体。ESCC是普遍的食管癌形式,主要发生在亚洲,中国占据有50%的患者人群。此前该药已经在美国完成实体肿瘤I期临床研究,CANbridge现在将在中国开始Ib/III阶段研究。
CAN017是人源化IgG1单克隆抗体,其靶向人v-erb-B2癌基因同源物3(HER-3)受体并抑制ERBB3活性。在临床前研究中,大量的临床研究模型已经证明,CAN017治疗应答率和NR G1阳性肿瘤表达率具有正相关,并且体内疗效可以通过肿瘤中NR G1的表达水平来预测。CAN017在各种转移性或晚期实体肿瘤上完成的I期研究也表明,该药耐受性良好。

3
FDA受理了ALXN1210治疗阵发性睡眠性血红蛋白尿症(PNH)的申请并予以优先审评
8月21日,美国,Alexion制药有限公司今天宣布FDA已接受审查该公司的BLA,以批准该公司的长效C5补体抑制剂ALXN 1210用于治疗阵发性夜间血红蛋白尿症(PNH),并予以优先审查,FDA将在2019年2月18日予以最后批复。如果获得批准,ALXN 1210将是PNH患者临床可用的第一种也是唯一一种长效补体抑制剂,可完全抑制体内C5补体蛋白活性长达8周。该药目前已经在美国和欧洲提交了上市申请,按照计划将在下半年在日本提交上市申请。
4
FDA批准KEYTRUDA与培美曲塞和铂化疗相结合用于非小细胞肺癌转移患者的一线治疗
8月21日,美国,默克公司今天宣布FDA批准了KEYTRUDA扩大适应症的申请,批准该药与培美曲塞和铂化疗相结合,用于没有EGFR或ALK基因组肿瘤畸变的转移性非小细胞肺癌患者的一线治疗。在一项关键的III期KEYNOTE-189试验数据显示,不管患者肿瘤中PD-L1的表达状况如何,相比于单一化疗,KEYTRUDA联合培美曲塞和铂类化疗显示总体生存率有有显著改善。KEYTRUDA正在迅速成为治疗转移性非小细胞肺癌的基础用药,此次根据KEYNOTE-189试验的数据扩大KEYTRUDA的用药人群具有重要里程碑意义。
5
首个Humira(Adalimumab)生物类似药在国内申请上市
8月21日,中国,Bio Thera Solutions公司今天宣布CNDA已经受理了对BAT1406生物制剂许可证申请。BAT1406是Humira(Adalimumab)的生物类似药,用于治疗类风湿性关节炎、银屑病关节炎、强直性脊柱炎、克罗恩病、溃疡性结肠炎、慢性银屑病、化脓性关节炎和青少年特发性关节炎。BAT1406是目前在中国申请上市的第一个Adalimumab生物类似药。

6
Viela Bio公司启动在研新药VIB9600首个人体临床试验
8月21日,美国,Viela Bio今天宣布该公司在研新药VIB9600首个人体临床试验正式开始,目前正处于患者招募阶段。这是用于治疗免疫介导的疾病而研发的一款新药,首批受试者已经签署知情同意书,预计将在今年九月开始首次给药试验。

Viela Bio的在研新药
7
ProMIS公司治疗阿尔茨海默病新药PMN310获得更为积极的安全性数据
8月21日,美国,ProMIS公司今日宣布经过PMN310治疗的AD脑样品中没有显示出与β淀粉样a斑块结合的沉积物检出。治疗性抗体与脑组织尤其是血管中的沉积物的结合被认为是ARIA(淀粉样蛋白相关成像异常;脑肿胀和微出血)形成的直接原因,而这一沉积物的产生严重影响患者脑部供血和生命安全。研究数据显示PMN310对a型低聚物的选择性比Aducanumab高,与其同类型产品BAN2401和Aducanumab形成鲜明对比,并不会给患者增加患者脑部新的沉积物,极大的提升了患者治疗的安全性。
PMN310可以选择性地靶向可溶性有毒的a寡聚物,而不靶向a型斑块,特别是在大脑血管内和血管周围的斑块。同类型产品BAN2401和Aducanumab因为脑肿胀的发生而不得不限制给药剂量。现有的安全性数据证实PMN310的安全性将允许给予AD患者更高的剂量,从而进一步增加患者的临床疗效。

8
OSE Immunotherapeutics SA公布了其在研新药FR104的临床前疗效数据
8月22日,法国,OSE Immunotherapeutics SA公司今日宣布其在研新药FR104(控制效应T淋巴细胞活性的受体CD28的拮抗剂)的疗效验证性研究取得积极进展,详细的研究结果发表在新一期的《JCI》杂志上。FR104是靶向CD28的单克隆抗体,这种聚乙二醇化单价抗体可以选择性抑制CD28受体介导的信号转导,在自身免疫疾病和移植中具有潜在的临床应用价值。

9
FDA受理了Elotuzumab加Pomalidomide和小剂量地塞米松治疗复发或难治性多发性骨髓瘤的临床应用申请
8月24日,美国,BMS公司今日宣布FDA已经受理了其Elotuzumab的补充生物制剂许可证申请,该申请要求Elotuzumab联合与泊马多胺和低剂量地塞米松用于治疗复发/难治性多发性骨髓瘤的治疗。此项申请是基于II期临床研究Pentic-3的数据,该研究评估了联合疗法对于RRMM患者的临床疗效和安全性。数据显示,经受过另种疗法治疗的RRMM经治患者对于Pomalidomide和地塞米松治疗的应答率显著降低,此时添加Elotuzumab进行联合治疗,患者疾病进展的风险降低46%,PFS中位数提高到10.3个月,而并不增加不良反应的发生率。
10
TAKHZYRO(Lanadelumab-flio)注射液获批用于HAE发作的预防治疗
8月26日,美国,Shire PLC公司今天宣布经过优先审查FDA批准了TAKHZYRO (Lanadelumab-flio)注射液,用于12岁及以上患者的遗传性血管水肿(HAE)发作的预防治疗。HAE是一种罕见的具有潜在威胁生命的遗传性疾病,可引起身体不同部位出现反复水肿或肿胀。TAKHZYRO是唯一一种能够靶向抑制血浆激肽释放酶的单克隆抗体,这种酶在HAE患者体内的表达得不到有效控制。